Blod-hjärnbarriären
Blod-hjärnbarriären är mycket tätt sammanfogade kapillärväggar i hjärnans blodkärl som skyddar hjärnvävnaden. Blod-hjärnbarriären hindrar vissa droger, läkemedel och celler (till exempel vita blodkroppar, mikroorganismer) från att lämna blodbanan och nå hjärnans nervceller. Blod-hjärnbarriären utgör ett skydd mot bland annat infektion i hjärnan och är essentiell för det centrala nervsystemets funktion. Det rika nätverket av kapillärer i hjärnan medför att en nervcell aldrig befinner sig mer än 50 µm från en kapillär. Många av de blodburna kemiska substanser som cirkulerar i kroppen hindras dock från att nå hjärnan och ryggmärgen tack vare blod-hjärnbarriären. Till skillnad från blodkärl i det perifera blodcirkulationssystemet, som är mycket genomsläppliga, tillåter blod-hjärnbarriären en begränsad upptagning av ämnen i blodet. Ämnen som regelbundet passerar in genom blod-hjärnbarriären till hjärnans extracellulära vätska är syre, glukos och aminosyror. Ett annat exempel på regelbunden transport gäller utträde av koldioxid och andra avfallsämnen genom blod-hjärnbarriären till blodcirkulationen.[1]
Det finns strategiska platser i hjärnan där blod-hjärnbarriären saknas. Områdenas kollektiva namn är circumventrikulära organ och avsaknaden av blod-hjärnbarriär på de platser som ingår i gruppen tillåter diffusion av blodburna molekyler. Genom diffusion på dessa områden regleras endokrina funktioner och även funktioner förknippade med det autonoma nervsystemet.[2] Hypofysen är ett sådant område utan blod-hjärnbarriär och där utsöndras och upptas hormon. Vid tallkottkörteln saknas också blod-hjärnbarriär vilket möjliggör upptagning av hormoner som påverkar strukturens reglering av dygnsrytm. I area postrema leder avsaknaden av blod-hjärnbarriären till att kräkreflexen kan starta när giftiga substanser återfinns i blodet.[1] Övriga områden som ingår i det kollektiva namnet circumventrikulära organ är subfornikala organ och subkomissurala organ.[2]
Det finns indikationer på att blod-hjärnbarriärens genomsläpplighet ökar med åldrandet. Särskilt stor ökning har funnits hos patienter med demens (i synnerhet vaskulärdemens) och patienter med ökande skador i vit substans.[3]
Struktur[redigera | redigera wikitext]
Blod-hjärnbarriären består av tre cellulära element: endotelceller (som utgör kapillären), astrocytutskott och pericyter. Allt tyder på att alla komponenter av blod-hjärnbarriären är viktiga för en fungerande och stabil blod-hjärnbarriär.[4] Ibland ingår även extracellulär matrix och neuron i det som beskrivs som den neurovaskulära enheten blod-hjärnbarriären.[5]
Endotelceller[redigera | redigera wikitext]
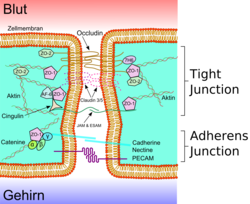
Blod-hjärnbarriärens endotelceller skiljer sig nämnvärt från vävnad i perifera endotelceller. I blod-hjärnbarriären har endotelceller täta fogar och zonula adherens, som är en form av celladhesion. Täta fogar och celladhesion begränsar paracellulär genomsläpplighet och medför avsaknad av fenestration.[4]Genom att de bildar en dragkedja mellan intilliggande celler begränsar täta fogarna och celladhesion genomsläpplighet av blodburna molekyler.[6] Celladhesionen består av ett cadherin-cateninkomplex och ger stöd till cellens struktur. Strukturen får ytterligare stöd från basala lamina, en 30–40 nm tjock matrix, som består av typ IV kollagen, proteoglycans, fibronectin, laminin och andra proteiner i extracellulär matrix.[2] De täta fogarna består av fibrer och omfattar tre sorter integralt membranprotein; claudiner, occludiner och celladhesionsmolekyler. De omfattar även ett antal cytoplasmiska proteiner som ZO-1, ZO-2, ZO-3 och cingulin.[4] Tack vare täta fogar delas plasmamembranet upp i två skilda domäner. Ett apikalt membran som är riktat mot blodflödet och ett basolateralt membran som är riktat mot hjärnvävnad.[6] Endotelceller i hjärnan har därför särskilda egenskaper som är unika i jämförelse med övrig endotelium. Utöver det ovan nämnda innebär de specifika egenskaperna en barriär mot enzymer, elektrisk transendotelisk resistens, minimal vesikulär transport och större volym och antal av mitokondriskt innehåll.[2]
Astrocytutskott[redigera | redigera wikitext]

Astrocyter, som är en typ av gliacell, är stjärnformade och fäster runt blodkärlet via fotliknande utskott. 80-90 % av kapillären täcks av astrocytutskotten. Tidigare ansåg man att astrocyter var avgörande för blod-hjärnbarriären när det gäller genomsläpplighet men dagens forskning pekar på att astrocytens största funktion är att upprätthålla kretsloppet av näring och avfall. Ett kretslopp mellan kapillärerna och hjärnans extracellullära vätska och nervceller.[1]Astrocyterna håller kapillärerna och neuronerna skilda från varandra. Interaktionen mellan endotelcellerna och astrocyterna är viktig för blod-hjärnbarriären och det finns växande bevis för att endotelcellerna har en ömsesidig framkallande influens över astrocyterna.[7] Molekulära faktorer som frigörs från gliaceller, som till exempel neurotrofisk faktor GDNF bidrar till stabiliteten i blod-hjärnbarriärens uniformitet.[2]
Pericyter[redigera | redigera wikitext]
Pericyter finns inbäddade i basala lamina och återfinns därav mellan endotelcellerna och astrocyterna. Det finns studier som visar på att pericyter kan framkalla att endotelceller tätnar genom att reglera täta fogarnas celldelning, differentiering och formation i endotelcellerna. Pericyter i blod-hjärnbarriären har visat en fagocyterande förmåga som kan vara tecken på att de är inblandade i neuroimmunologiska funktioner. Dessutom ger pericyter i blod-hjärnbarriären uttryck för ett antal receptorer för vasoaktiva ämnen vilket tyder på att de också kan vara inblandade i hjärnans självreglering.
Funktion[redigera | redigera wikitext]
Enkel diffusion[redigera | redigera wikitext]
Trots att blod-hjärnbarriären är 50-100 gånger tätare än blodkärl i resten av kroppen och att många ämnen hindras från att komma in till extracellullär vätska i det centrala nervsystemet är det vissa molekyler som kan korsa blod-hjärnbarriären. Det finns två huvudsakliga sätt som blodburna molekyler kan ta sig igenom. Ett sätt kallas passivt eller enkelt och har att göra med molekylernas egenskaper vad gäller fettlöslighet och laddning. Små molekyler som syre och koldioxid är fettlösliga och inte joniserade och kan därför passera blod-hjärnbarriären fritt via diffusion längs deras koncentrationsgradient. Generellt gäller att ju mer fettlöslig en molekyl är (vilket ger ingen eller liten polär karaktär) desto lättare är det för den att passera in i eller ut från endotelcellerna i hjärnan.[2]
Receptormedierad diffusion[redigera | redigera wikitext]
Många viktiga metaboliska substanser är mycket polariserade och har därför ingen genomsläpplighet. Molekyler tillhörande glukos, aminosyror och andra näringsämnen är exempel på substanser som är nödvändiga för centrala nervsystemets funktion men som inte kan ta sig igenom blod-hjärnbarriären fritt. Den här typen av molekylers transportsystem är receptormedierade och kräver inte heller energi utan förflyttning sker längs ämnets koncentrationsgradiens. Diffusion sker i det här fallet genom bärare som transporterar specifika substanser. Lösta molekyler binds till specifika membranprotein som är bärare genom blod-hjärnbarriären. Det finns olika system för att tillgodose hjärnans metaboliska efterfrågan. Glukostransportör-1 (GLUT-1), L-systemet och A-systemet för aminosyrebärare, för att nämna några.[2]
Aktivt transportsystem[redigera | redigera wikitext]
Det andra sättet är via ett aktivt transportsystem som kräver energi. Dessa transportsystem består av jonkanaler lika dem i nervcellerna.[1]
Endocytos[redigera | redigera wikitext]
Det finns ännu en viktig mekanism när det gäller centrala nervsystemets upptagning av ämnen. Den heter endocytos och är en process där celler absorberar material genom att innesluta det i cellmembranet. Endocytos är begränsad i hjärnans vaskulära system jämfört med kapillärer i resten av kroppen. Det finns dock två typer av endocytos som tillåter centrala nervsystemet att selektiv uppta makromolekyler. Reglerad upptagning av hormoner, tillväxt faktorer, enzymer och insulin är möjliga genom dessa mekanismer som är högt specialiserade i blod-hjärnbarriären.[2]
Ökad genomsläpplighet[redigera | redigera wikitext]
Hjärnskador[redigera | redigera wikitext]
Att blod-hjärnbarriären tappar ogenomtränglighet och öppnar upp sig mer eller mindre är kritiskt för neurologiska sjukdomars utveckling och framskridande. Ökad genomsläpplighet i blod-hjärnbarriären är förknippat med en rad olika hjärnskador, som till exempel traumatisk hjärnskada, hjärninfarkt, hjärnblödning, inflammatoriska sjukdomar som hjärnhinneinflammation och allvarliga toxiska metaboliska rubbningar. Det finns också en rad patologiska förändringar av blod-hjärnbarriären som leder till nedbrytning av funktionen.[2]
Normalprocess[redigera | redigera wikitext]
Det finns dock modesta och reversibla förändringar i blod-hjärnbarriärens ogenomtränglighet som är en reglerad normalprocess och uppstår som svar på frigjorda agenter. I plasman finns till exempel faktorer som krävs för läkningsprocesser i hjärnan samt för immunologisk övervakning av centrala nervsystemet. De molekyler som kan påverka blod-hjärnbarriärens täthet kommer från tre källor; endotelium, astrocyter och nervterminaler som befinner sig i närheten av kapillärer. Många av dessa kemiska budbärare har identifierats, som till exempel glutamat, aspartat, taurin, ATP, endotelin-1, kväveoxid, tumörnekrosfaktor alpha och interleukin 1-beta. Andra humorala agenter som ökar genomsläpplighet är bradykinin, serotonin, histamin, och substans P. Den här typen av reglerad ökning av genomsläpplighet sker till följd av att de täta fogarnas paracellulära gångar tillfälligt öppnas.[2][4]
Referenser[redigera | redigera wikitext]
- ^ [a b c d] Kolb, Bryan; Whishaw, Ian Q. (2008). Fundamentals of human neuropsychology (6th ed.). Basingstoke: Palgrave Macmillan. ISBN 978-0-7167-9586-5
- ^ [a b c d e f g h i j] Lawther, B. K.; Kumar, S.; Krovvidi, H. (19 June 2011). ”Blood-brain barrier”. Continuing Education in Anaesthesia, Critical Care & Pain 11 (4): sid. 128–132. doi:.
- ^ Farrall, Andrew J.; Wardlaw, Joanna M. (March 2009). ”Blood–brain barrier: Ageing and microvascular disease – systematic review and meta-analysis”. Neurobiology of Aging 30 (3): sid. 337–352. doi:. PMID 17869382.
- ^ [a b c d] Ballabh, Praveen; Braun, Alex; Nedergaard, Maiken (June 2004). ”The blood–brain barrier: an overview”. Neurobiology of Disease 16 (1): sid. 1–13. doi:. PMID 15207256.
- ^ Hawkins, B. T.; Davis, T. P. (1 June 2005). ”The Blood-Brain Barrier/Neurovascular Unit in Health and Disease”. Pharmacological Reviews 57 (2): sid. 173–185. doi:. PMID 15914466.
- ^ [a b] Georgieva, Julia; Hoekstra, Dick; Zuhorn, Inge (17 November 2014). ”Smuggling Drugs into the Brain: An Overview of Ligands Targeting Transcytosis for Drug Delivery across the Blood–Brain Barrier”. Pharmaceutics 6 (4): sid. 557–583. doi:. PMID 25407801.
- ^ Abbott, N. Joan; Rönnbäck, Lars; Hansson, Elisabeth (January 2006). ”Astrocyte–endothelial interactions at the blood–brain barrier”. Nature Reviews Neuroscience 7 (1): sid. 41–53. doi:. PMID 16371949.
