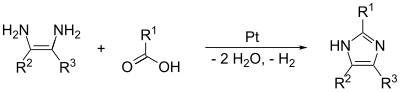Imidazol
| Imidazol | |
  | |
| Systematiskt namn | 1,3-diazaol, 1,3-diazacyklopenta-2,4-dien |
|---|---|
| Övriga namn | Glyoxalin |
| Kemisk formel | HC3H3N2 |
| Molmassa | 68,08 g/mol |
| Utseende | Vita till blekgula kristaller |
| CAS-nummer | 288-32-4 |
| SMILES | C1=CN=CN1 |
| Egenskaper | |
| Densitet | 1,23 g/cm³ |
| Löslighet (vatten) | 633 g/l |
| Smältpunkt | 89 – 91 °C |
| Kokpunkt | 256 °C |
| Faror | |
| Huvudfara | |
| LD50 | 970 mg/kg |
| SI-enheter & STP används om ej annat angivits | |
Imidazol är en organisk förening med formeln HC3H3N2. Den är ett vitt eller färglöst fast ämne som är lösligt i vatten och ger en svagt alkalisk lösning. Denna aromatiska heterocykliska organiska förening är klassificerad som en diazol, och har icke-intilliggande kväveatomer i metasubstitution.
Många naturliga produkter, särskilt alkaloider, innehåller imidazolringen. Dessa imidazoler delar 1,3-C3N2-ringen men har olika substituenter. Detta ringsystem finns i viktiga biologiska byggstenar, såsom histidin och det relaterade hormonet histamin. Många läkemedel innehåller en imidazolring, såsom vissa antimykotika, nitroimidazolserien av antibiotika och det lugnande medel midazolam. [1][2][3][4][5]
När den smälts till en pyrimidinring bildar den en purin, som är den mest förekommande kvävehaltiga heterocykeln i naturen.[6]
Namnet "imidazol" myntades 1887 av den tyske kemisten Arthur Rudolf Hantzsch (1857–1935).[7]
Struktur och egenskaper[redigera | redigera wikitext]
Imidazol är en plan 5-ledad ring, som finns i två ekvivalenta tautomera former eftersom väte kan bindas till en eller en annan kväveatom. Imidazol är en mycket polär förening, vilket framgår av dess elektriska dipolmoment på 3,67 D,[8] och är mycket löslig i vatten. Föreningen klassificeras som aromatisk på grund av närvaron av en plan ring som innehåller 6 π-elektroner (ett par elektroner från den protonerade kväveatomen och en från var och en av de återstående fyra atomerna i ringen). Några resonansstrukturer av imidazol visas nedan:
Amfoterism[redigera | redigera wikitext]
Imidazol är amfoter, vilket vill säga att den kan fungera både som en syra och som en bas. Som en syra är pKa för imidazol 14,5, vilket gör den mindre sur än karboxylsyror, fenoler och imider, men något surare än alkoholer. Den sura protonen är den som är bunden till kväve. Deprotonering ger imidazolidanjonen, som är symmetrisk. Som bas är pKa för konjugatsyran (citerad som pKBH+ för att undvika förväxling mellan de två) ungefär 7, vilket gör imidazol ungefär sextio gånger mer basisk än pyridin. Den grundläggande platsen är kvävet med det ensamma paret (och inte bundet till väte). Protonering ger imidazoliumkatjonen, som är symmetrisk.
Framställning[redigera | redigera wikitext]
Imidazol rapporterades första gången 1858 av den tyske kemisten Heinrich Debus, även om olika imidazolderivat hade upptäckts så tidigt som på 1840-talet. Det visades att glyoxal, formaldehyd och ammoniak kondenserar för att bilda imidazol (glyoxalin, som det ursprungligen hette).[9] Denna syntes, även om den ger relativt låga utbyten, används fortfarande för att generera C-substituerade imidazoler.
I mikrovågsmodifiering är reaktanterna bensil, bensaldehyd och ammoniak i isättika, vilket bildar 2,4,5-trifenylimidazol ("lofin").[10]
Imidazol kan syntetiseras med flera metoder förutom Debus-metoden. Många av dessa synteser kan också appliceras på olika substituerade imidazoler och imidazolderivat genom att variera de funktionella grupperna på reaktanterna. Dessa metoder kategoriseras vanligtvis efter vilka och hur många bindningar som bildas för att göra imidazolringarna. Till exempel bildar Debus-metoden (1,2), (3,4) och (1,5)-bindningarna i imidazol, genom att använda varje reaktant som ett fragment av ringen, och därför skulle denna metod vara en trebindning-bildande syntes. Ett litet urval av dessa metoder presenteras nedan.
Bildandet av en bindning[redigera | redigera wikitext]
(1,5)- eller (3,4)-bindningen kan bildas genom reaktion av ett midat och en α-aminoaldehyd eller α-aminoacetal. Exemplet nedan gäller imidazol när R1 = R2 = väte.
Bildandet av två bindningar[redigera | redigera wikitext]
(1,2)- och (2,3)-bindningarna kan bildas genom att behandla en 1,2-diaminoalkan, vid höga temperaturer, med en alkohol, aldehyd eller karboxylsyra. En dehydreringskatalysator, såsom platina på aluminiumoxid, krävs.
(1,2)- och (3,4)-bindningarna kan också bildas från N-substituerade a-aminoketoner och formamid med värme. Produkten kommer att vara en 1,4-disubstituerad imidazol, men här eftersom R1 = R2 = väte, är imidazol själv produkten. Utbytet av denna reaktion är måttligt, men det verkar vara den mest effektiva metoden för att göra 1,4-substitutionen.
Bildandet av fyra bindningar[redigera | redigera wikitext]
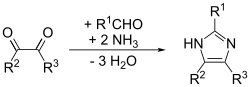
Detta är en allmän metod som kan ge goda utbyten för substituerade imidazoler. I huvudsak är det en anpassning av Debus-metoden som kallas Debus-Radziszewski-imidazolsyntesen. Utgångsmaterialen är substituerad glyoxal, aldehyd, amin och ammoniak eller ett ammoniumsalt.[11]
Bildning från andra heterocykler[redigera | redigera wikitext]
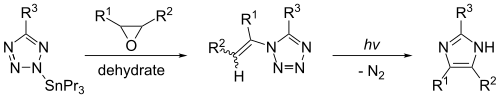
Imidazol kan syntetiseras genom fotolys av 1-vinyltetrazol. Denna reaktion ger betydande utbyten endast om 1-vinyltetrazolen framställs effektivt av en organisk tennförening, såsom 2-tributylstannyltetrazol. Reaktionen, som visas nedan, ger imidazol när R1 = R2 = R3 = väte.
Imidazol kan också bildas i en ångfasreaktion. Reaktionen sker med formamid, etylendiamin och väte över platina på aluminiumoxid, och den måste ske mellan 340 och 480 °C. Detta bildar en mycket ren imidazolprodukt.
Van Leusens reaktion[redigera | redigera wikitext]
Van Leusen-reaktionen kan också användas för att bilda imidazoler från TosMIC och enaldimin. Van Leusen Imidazol-syntesen gör en framställning av imidazoler från aldiminer genom reaktion med tosylmetylisocyanid (TosMIC). Reaktionen har senare utvidgats till en tvåstegssyntes där aldimin genereras in situ: Van Leusen Three-Component Reaction (vL-3CR).[12]
Biologisk betydelse och tillämpningar[redigera | redigera wikitext]
Imidazol ingår i många viktiga biologiska föreningar. Den mest genomgripande är aminosyran histidin, som har en imidazolsidokedja. Histidin finns i många proteiner och enzymer, till exempel genom att binda metallkofaktorer, som ses i hemoglobin.
Imidazolbaserade histidinföreningar spelar en mycket viktig roll vid intracellulär buffring.[13] Histidin kan dekarboxyleras till histamin. Histamin kan orsaka nässelutslag (nässelutslag) när det produceras under allergisk reaktion.
Imidazolsubstituenter finns i många läkemedel. Syntetiska imidazoler finns i många svampdödande medel och antifungala, antiprotozoala och antihypertensiva mediciner. Imidazol är en del av teofyllinmolekylen, som finns i teblad och kaffebönor, som stimulerar det centrala nervsystemet. Det finns i anticancerläkemedlet merkaptopurin, som bekämpar leukemi genom att störa DNA-aktiviteter.
Ett antal substituerade imidazoler, som klotrimazol, är selektiva hämmare av kväveoxidsyntas, vilket gör dem till intressanta läkemedelsmål vid inflammation, neurodegenerativa sjukdomar och tumörer i nervsystemet.[14][15] Andra biologiska aktiviteter av imidazolfarmakoforen relaterar till nedregleringen av intracellulära Ca2+ and K+-flöden och interferens med translationsinitiering.[16]
Farmaceutiska derivat[redigera | redigera wikitext]
De substituerade imidazolderivaten är värdefulla vid behandling av många systemiska svampinfektioner.[17] Imidazoler tillhör klassen av azol-antimykotika, som inkluderar ketokonazol, mikonazol och klotrimazol.
Som jämförelse är en annan grupp av azoler triazolerna, som inkluderar flukonazol, itrakonazol och vorikonazol. Skillnaden mellan imidazolerna och triazolerna är mekanismen för hämning av cytokrom P450-enzymet. N3 i imidazolföreningen binder till hemjärnatomen i ferricytokrom P450, medan N4 i triazolerna binder till hemgruppen. Triazolerna har visat sig ha en högre specificitet för cytokrom P450 än imidazoler, vilket gör dem mer potenta än imidazolerna.[18]
Vissa imidazolderivat uppvisar effekter på insekter, till exempel har sulkonazolnitrat en stark anti-matningseffekt på den keratinsmältande australiska mattbaggelarverna Anthrenocerus australis, liksom ekonazolnitrat med den vanliga klädesmalen Tineola bisselliella.[19]
Industriella tillämpningar[redigera | redigera wikitext]
Imidazol i sig har få direkta tillämpningar. Den är istället grundmaterial till en mängd olika jordbrukskemikalier, såsom enilconazol, climbazol, klotrimazol, prochloraz och bifonazol.[20]

Användning i biologisk forskning[redigera | redigera wikitext]
Imidazol är en lämplig buffert för pH 6,2-7,8,[21]. Ren imidazol har i huvudsak ingen absorbans vid proteinrelevanta våglängder (280 nm),[22][23] men lägre renhet av imidazol kan ge anmärkningsvärd absorbans vid 280 nm. Imidazol kan störa Lowry-proteinanalysen.[24]
Säkerhet[redigera | redigera wikitext]
Imidazol har låg akut toxicitet, vilket indikeras av LD50 på 970 mg/kg (råtta, oral).[20]
Se även[redigera | redigera wikitext]
Referenser[redigera | redigera wikitext]
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Imidazole, 14 januari 2022.
Noter[redigera | redigera wikitext]
- ^ Karitzky, A. R.; Rees, C.W.R.; Scriven, E.F.V. (1984). Comprehensive Heterocyclic Chemistry. "5". Sid. 469–498. ISBN 978-0-08-042072-1.
- ^ Grimmett, M. Ross (1997). Imidazole and Benzimidazole Synthesis. Academic Press. ISBN 978-0-08-053445-9.
- ^ Brown, E. G. (1998). Ring Nitrogen and Key Biomolecules. Kluwer Academic Press. ISBN 978-94-011-4906-8.
- ^ Pozharskii, A. F. (1997). Heterocycles in Life and Society. John Wiley & Sons. ISBN 978-0-471-96033-1.
- ^ Gilchrist, T. L. (1985). Heterocyclic Chemistry. Bath Press. ISBN 978-0-582-01421-3.
- ^ Rosemeyer, H. (2004). ”The Chemodiversity of Purine as a Constituent of Natural Products”. Chemistry & Biodiversity 1 (3): sid. 361–401. doi:. PMID 17191854.
- ^ Hantzsch, A. and Weber, J. H. (1887) "Ueber Verbindungen des Thiazols (Pyridins der Thiophenreihe)" (On compounds of thiazole (pyridines of the thiophene series), Berichte der deutschen chemischen Gesellschaft, 20 : 3118–3132, see p. 3119. See also: Hantzsch, A. (1888) "Allegemeine Bemerkungen über Azole" (General observations about azoles), Annalen der Chemie, 249 : 1–6. Hantzsch proposed a reform of the nomenclature of azole compounds, including a proposal to call the heterocyclic ring C3H3(NH)N "imidazole" ; see pp. 2 and 4.
- ^ Christen, Dines; Griffiths, John H.; Sheridan, John (1981). ”The Microwave Spectrum of Imidazole; Complete Structure and the Electron Distribution from Nuclear Quadrupole Coupling Tensors and Dipole Moment Orientation”. Zeitschrift für Naturforschung A 36 (12): sid. 1378–1385. doi:. Bibcode: 1981ZNatA..36.1378C.
- ^ Debus, Heinrich (1858). ”Ueber die Einwirkung des Ammoniaks auf Glyoxal”. Annalen der Chemie und Pharmacie 107 (2): sid. 199–208. doi:. https://babel.hathitrust.org/cgi/pt?id=njp.32101044011045;view=1up;seq=211. From p. 205: "Die gereinigte Substanz stellt das oxalsaure Salz einer Basis dar, die ich mit Glyoxalin bezeichenen werde." (The purified substance constitutes the oxalic salt of a base, which I will designate as "glyoxaline".)
- ^ Crouch, R. David; Howard, Jessica L.; Zile, Jennifer L.; Barker, Kathryn H. (2006). ”Microwave-Mediated Synthesis of Lophine: Developing a Mechanism To Explain a Product”. J. Chem. Educ. 83 (11): sid. 1658. doi:. Bibcode: 2006JChEd..83.1658C.
- ^ US patent 6,177,575, Arduengo, A. J., "Process for Manufacture of Imidazoles", utgivet 2001-01-23
- ^ Van Leusen, Albert M.; Wildeman, Jurjen; Oldenziel, Otto H. (1977). ”Chemistry of sulfonylmethyl isocyanides. 12. Base-induced cycloaddition of sulfonylmethyl isocyanides to carbon, nitrogen double bonds. Synthesis of 1,5-disubstituted and 1,4,5-trisubstituted imidazoles from aldimines and imidoyl chlorides”. Journal of Organic Chemistry 42 (7): sid. 1153–1159. doi:. Bibcode: 1977JOrgC..42.1153A.
- ^ Hochachka, P. W.; Somero, G. N. (2002). Biochemical Adaptation: Mechanisms and Process in Physiological Evolution. New York: Oxford University Press.
- ^ Castaño, T.; Encinas, A.; Pérez, C.; Castro, A.; Campillo, N. E.; Gil, C. (2008). ”Design, synthesis, and evaluation of potential inhibitors of nitric oxide synthase”. Bioorg. Med. Chem. 16 (11): sid. 6193–6206. doi:. PMID 18477512. https://digital.csic.es/bitstream/10261/87090/1/accesoRestringido.pdf.
- ^ Bogle, R. G.; Whitley, G. S.; Soo, S. C.; Johnstone, A. P.; Vallance, P. (1994). ”Effect of anti-fungal imidazoles on mRNA levels and enzyme activity of inducible nitric oxide synthase”. Br. J. Pharmacol. 111 (4): sid. 1257–1261. doi:. PMID 7518297.
- ^ Khalid, M. H.; Tokunaga, Y.; Caputy, A. J.; Walters, E. (2005). ”Inhibition of tumor growth and prolonged survival of rats with intracranial gliomas following administration of clotrimazole”. J. Neurosurg. 103 (1): sid. 79–86. doi:. PMID 16121977.
- ^ Leon Shargel (2007). Comprehensive Pharmacy Review (6th). Sid. 930. ISBN 9780781765619.
- ^ Davis, Jennifer L.; Papich, Mark G.; Heit, Mark C. (2009). ”Chapter 39: Antifungal and Antiviral Drugs”. i Riviere, Jim E.; Papich, Mark G.. Veterinary Pharmacology and Therapeutics (9th). Wiley-Blackwell. Sid. 1019–1020. ISBN 978-0-8138-2061-3.
- ^ Sunderland, M. R.; Cruickshank, R. H.; Leighs, S. J. (2014). ”The efficacy of antifungal azole and antiprotozoal compounds in protection of wool from keratin-digesting insect larvae”. Textile Res. J. 84 (9): sid. 924–931. doi:.
- ^ [a b] Ebel, K., Koehler, H., Gamer, A. O., & Jäckh, R. (2002). "Imidazole and Derivatives". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a13_661.
- ^ Dawson, R. M. C. (1986). Data for biochemical research. Oxford: Clarendon Press. Sid. 325. ISBN 978-0-19-855299-4. OCLC 11865673.
- ^ ”1H-Imidazole”. https://webbook.nist.gov/cgi/cbook.cgi?ID=C288324&Mask=400. Läst 13 maj 2021.
- ^ ”Optimizing Purification of Histidine-Tagged Proteins”. https://www.sigmaaldrich.com/technical-documents/protocols/biology/affinity-chromatography-tagged-proteins/optimizing-purification-of-histidine-tagged-proteins.html. Läst 13 maj 2021.
- ^ Molina, F; Rueda, A; Bosque-Sendra, J.M; Megias, L (1996). ”Determination of proteins in the presence of imidazole buffers”. Journal of Pharmaceutical and Biomedical Analysis (Elsevier BV) 14 (3): sid. 273–280. doi:. ISSN 0731-7085. PMID 8851751.
Externa länkar[redigera | redigera wikitext]
 Wikimedia Commons har media som rör Imidazol.
Wikimedia Commons har media som rör Imidazol.
|