Järn(III)fosfat
| Järn(III)fosfat | |
  | |
| Systematiskt namn | Järn(III)fosfat |
|---|---|
| Övriga namn | Järnortofosfat |
| Kemisk formel | FePO4 |
| Molmassa | 150,815 g/mol |
| Utseende | Ljustbrunt pulver |
| CAS-nummer | 10045-86-0 |
| SMILES | [O-]P(=O)([O-])[O-].[Fe+3] |
| Egenskaper | |
| Densitet | 3,056 g/cm 3 (vattenfri) 2,87 g/cm3 (20 °C, dihydrat) g/cm³ |
| Löslighet (vatten) | Vattenfri:olöslig, dihydrat: 0,642 g/100 ml (100 °C) [1] |
| Smältpunkt | 250 °C (sönderfaller) |
| Faror | |
| Huvudfara | |
| NFPA 704 | |
| SI-enheter & STP används om ej annat angivits | |
Järn(III)fosfat eller Järnortofosfat[2][3] är en förening av trevärt järn och fosfatjoner med formeln FePO4. Flera besläktade material är kända, såsom fyra polymorfer av FePO4 och två polymorfer av dihydratet FePO4·(H2O)2. Dessa material har få tekniska tillämpningar eller förekomster i mineralriket.[4][5]
Struktur[redigera | redigera wikitext]
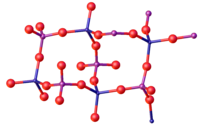
Den vanligaste formen av FePO4 antar strukturen hos α-kvarts. Som sådant består materialet av tetraedriska Fe(III)- och fosfatplatser.[6] Som sådan har P och Fe tetraedrisk molekylär geometri. Vid höga tryck sker en fasförändring till en tätare struktur med oktaedriska Fe-centra. Två ortorombiska strukturer och en monoklinisk fas är också kända. I dihydratets två polymorfer är Fe-centret oktaedriskt med cis-vattenligander på ömse sidor.[7]
Användning[redigera | redigera wikitext]
Järn(III)fosfat kan användas i stål- och metalltillverkningsprocesser. När det är bundet till en metallyta förhindrar järnfosfat ytterligare oxidation av metallen. Dess närvaro är delvis orsaken till korrosionsbeständigheten hos järnpelaren i Delhi.
Järnfosfatbeläggningar används vanligtvis som förberedelse för målning eller pulverlackering för att öka vidhäftningen till järn- eller stålsubstratet och förhindra korrosion, vilket kan orsaka för tidigt fel i efterföljande beläggningsprocesser. Det kan också användas för att binda tyger, trä och andra material till järn- eller stålytor.
Vattenfritt järnfosfat används också som material i den positiva elektroden i lithium-jon batterier. Inom keramik används det för att göra slitstark glasyr på klinker.
Bekämpningsmedel[redigera | redigera wikitext]
Järn(III)fosfat används som ett miljövänligt och giftfritt bekämpningsmedel mot sniglar, snäckor och andra mollusker och är ett av de få blötdjursmedel som är godkända för användning i ekologisk odling.[8]
Bekämpningsmedelspellets innehåller järnfosfat plus ett kelatbildande medel, såsom EDTA.[9] Research Institute of Organic Agriculture (FiBL) rapporterade EDTA-halten och uppgav att produkterna sannolikt inte var säkrare än metaldehydbeten.[10]
Säkerhet[redigera | redigera wikitext]
Järn(III)fosfat är inte tillåtet som livsmedelstillsats i Europeiska unionen. Det ströks från förteckningen över tillåtna ämnen i direktiv 2002/46/EG 2007.
Se även[redigera | redigera wikitext]
- Järn(II)fosfat, allmänt känt som järnfosfat, det lägre fosfatet av järn
- Fosfatering, en industriell process som används för att skydda nytillverkat järn och stål från korrosion
Referenser[redigera | redigera wikitext]
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Iron(III)phosphate, 26 maj 2022.
Noter[redigera | redigera wikitext]
- ^ ”iron(III) phosphate dihydrate”. chemister.ru. http://chemister.ru/Database/properties-en.php?dbid=1&id=4418.
- ^ ”Iron(III) Phosphate”. NIH, U.S. National Library of Medicine. https://pubchem.ncbi.nlm.nih.gov/compound/ferric_phosphate.
- ^ ”FERRIC PHOSPHATE”. EndMemo.com. http://www.endmemo.com/chem/compound/fepo4.php.
- ^ Roncal-Herrero, T., Rodriguez-Blanco, J.D., Benning, L.G., Oelkers, E.H. (2009) Precipitation of Iron and Aluminium Phosphates Directly from Aqueous Solution as a Function of Temperature from 50 to 200°C. Crystal Growth & Design, 9, 5197-5205. doi: 10.1021/cg900654m.
- ^ Song, Y.; Zavalij, P. Y.; Suzuki, M.; Whittingham, M. S. (2002). ”New Iron(III) Phosphate Phases: Crystal Structure and Electrochemical and Magnetic Properties”. Inorganic Chemistry 41 (22): sid. 5778–5786. doi:. PMID 12401083. http://materials.binghamton.edu/whittingham/pdfpapers/IC_41_5778_02.pdf. Läst 3 juli 2014. Arkiverad 14 juli 2014 hämtat från the Wayback Machine. ”Arkiverade kopian”. Arkiverad från originalet den 14 juli 2014. https://web.archive.org/web/20140714114934/http://materials.binghamton.edu/whittingham/pdfpapers/IC_41_5778_02.pdf. Läst 29 december 2022.
- ^ Haines, J.; Cambon, O.; Hull, S. (2003). ”A neutron diffraction study of quartz-type FePO4: High-temperature behavior and α–β phase transition”. Zeitschrift für Kristallographie - Crystalline Materials 218 (3): sid. 193. doi:. Bibcode: 2003ZK....218..193H.
- ^ Zaghib, K.; Julien, C. M. (January 2005). ”Structure and electrochemistry of FePO4·2H2O hydrate”. Journal of Power Sources 142 (1–2): sid. 279–284. doi:. Bibcode: 2005JPS...142..279Z. https://www.researchgate.net/publication/245105788. Läst 3 juli 2014.
- ^ ”COMMISSION REGULATION (EC) No 889/2008”. European Union law. http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=CONSLEG:2008R0889:20130101:EN:PDF.
- ^ ”The Regional Institute - Slugs, Snails and Iron based Baits: An Increasing Problem and a Low Toxic Specific Action Solution 1”. www.regional.org.au. 11 September 2018. http://www.regional.org.au/au/asa/2001/6/c/young.htm.
- ^ ”Archived copy”. Archived copy. http://www2.eduskunta.fi/kerhot/luonto/eurosiili/pdf/FIBL_FeP_Jan06_E.pdf. Arkiverad 10 juli 2007 hämtat från the Wayback Machine. ”Arkiverade kopian”. Arkiverad från originalet den 10 juli 2007. https://web.archive.org/web/20070710000906/http://www2.eduskunta.fi/kerhot/luonto/eurosiili/pdf/FIBL_FeP_Jan06_E.pdf. Läst 29 december 2022.
Externa länkar[redigera | redigera wikitext]
 Wikimedia Commons har media som rör Järn(III)fosfat.
Wikimedia Commons har media som rör Järn(III)fosfat.

