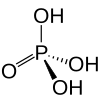
Fosforsyra
| Fosforsyra | |||
  | |||
| Systematiskt namn | Ortofosforsyra eller Fosfor(V)syra | ||
|---|---|---|---|
| Kemisk formel | H3PO4 | ||
| Molmassa | 98,00 g/mol | ||
| Utseende | Färglösa kristaller Flytande (>42 °C) | ||
| CAS-nummer | 7664-38-2 | ||
| SMILES | OP(=O)(O)O | ||
| Egenskaper | |||
| Densitet | 1,685 g/ml (flytande) g/cm³ | ||
| Löslighet (vatten) | 5480 g/l | ||
| Smältpunkt | 42,35 °C (21,1 °C vid 85 %) | ||
| Kokpunkt | 158 °C | ||
| Faror | |||
| Huvudfara |
| ||
| NFPA 704 | |||
| LD50 | 1530 mg/kg (oralt) | ||
| SI-enheter & STP används om ej annat angivits | |||

Fosforsyra, ortofosforsyra, är en medelstark syra med kemisk formel H3PO4. Den centrala atomen är fosfor. Fosforsyrans salter och estrar kallas fosfater. I rent tillstånd är fosforsyra ett färglöst, hårt, kristallint ämne med smältpunkt 42,35 °C och 21,1 °C vid 85 viktprocent.
Tillverkning[redigera | redigera wikitext]
Industriellt tillverkas fosforsyra i huvudsak efter två olika processvägar, våtprocessen och den termiska processen. Våtprocessen dominerar i den kommersiella sektorn medan den dyrare termiska processen används när kraven på renhet är höga, exempelvis inom livsmedelsindustrin.
Våtprocessen[redigera | redigera wikitext]
I våtprocessen får svavelsyra reagera med trikalciumfosfat, typiskt apatit. Reaktionen är
- Ca5(PO4)3X + 5 H2SO4 + 10 H2O → 3 H3PO4 + 5 CaSO4·2 H2O + HX
där X kan vara OH, F eller Cl
Den primärt tillverkade syran innehåller typiskt 32-46 % H3PO4 (23–33 % P2O5), men kan koncentreras genom att vatten avdunstas till den vanliga handelskvalitén av fosforsyra som innehåller omkring 75–85 % H3PO4 (54–62 % P2O5). Halten kan ökas ytterligare till närmare 70% P2O5 stökiometriskt svarande mot närmare 100 % H3PO4 men vid höga halter bildas pyrofosforsyra (H4P2O7) och eventuellt även högre polysyror som leder till mycket hög viskositet.[1][2]
Det vid reaktion bildade kalciumsulfatet filtreras av och kan tas tillvara som "fosforgips". Våtprocessad syra kan renas från fluor för att ge syran foderkvalitet och ytterligare rening (från arsenik med vätskeextraktion) kan ge livsmedelskvalitet.
I nitrofosfatprocessen, som endast används i liten utsträckning, används i stället salpetersyra för att man ska erhålla växtnäringsämnet kalciumnitrat som biprodukt.
Den termiska processen[redigera | redigera wikitext]
Mycket ren fosforsyra kan erhållas genom bränning av elementärt fosfor till fosforpentoxid som sedan löses i utspädd fosforsyra. Fosforn framställs ur fosfatråvaran genom att den blandas med kiseldioxid och koks eller kol. När denna blandning reagerar vid hög temperatur bildas kalciumsilikat, kolmonoxid och fosforånga. Fosforångan kan kondenseras till fosfor eller brännas direkt. Eftersom temperaturen måste vara mycket hög ställs höga och kostsamma krav på processutrustningen och energikostnaden blir hög. Åtminstone delvis används elektriska ugnar. För bästa processekonomi försöker man därför gärna att använda förbränningsvärmen från fosforn och kolmonoxiden för att täcka så stor del av energiförbrukningen som möjligt, vilket ytterligare höjer kraven på processutrustningen. Det mesta av föroreningarna avlägsnas då i samband med framställning av fosforn ur fosfatråvaran. Eftersom arsenik har egenskaper som liknar fosfor kan arseniken förångas på ett liknande sätt och ytterligare rening därför krävas. Slutresultatet är "termisk" fosforsyra av livsmedelskvalitet.
Användning[redigera | redigera wikitext]
Fosforsyra ingår i de flesta coladrycker samt i Trocadero för att ge en syrlig smak och ha en viss konserverande effekt. Detta till skillnad från de flesta andra läskedrycker där citronsyra används i stället. Allmänt används fosforsyra inom livsmedelsindustrin för surhetsreglering t.ex. vid osttillverkning och som antioxidationsmedel med E-nummer E 338. Olika salter av fosforsyra används också i livsmedel, t.ex. kalciumfosfat som antiklumpningsmedel i pulver och natrium- och kaliumfosfat som bakpulver.[3]
Fosforsyra används också för att lösa upp rost, för fosfatering av stål och rengöring av tandytan innan applicering av lagning. Vidare används fosforsyra som avkalkningsmedel [4].
Biokemi[redigera | redigera wikitext]
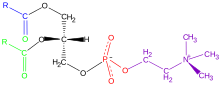
Fosforsyra ingår i kroppens normala ämnesomsättning. Kalciumfosfat utgör en väsentlig del av skelettet.[3] Kroppens energiomsättning använder också fosforsyra i form av adenosintrifosfat (ATP) och adenosindifosfat ADP. Fosforsyra är också en av grundkomponenterna i fosfolipider i kroppen. Fosfolipiderna är viktiga för uppbyggnaden av cellmembranen, och dess struktur framgår av exemplet i bilden. Fosfolipider är fosfatestrar av glycerol. De är estrar med två molekyler fettsyra och en molekyl fosforsyra. Fosforsyran har dessutom bildat ester med ytterligare en alkoholgrupp som oftast också innehåller en aminogrupp.
Meta-fosforsyra[redigera | redigera wikitext]
Meta-fosforsyra, (HPO3)n, utgörs av en hård, färglös massa som bildas genom förlust av en molekyl vatten ur fosforsyra vid långvarig upphettning. Salt av meta-fosforsyra kallas metafosfat. [5]
Se även[redigera | redigera wikitext]
Källor[redigera | redigera wikitext]
- ^ Thomas, W P and Lawton, W S "Stable ammonium polyphosphate liquid fertilizer from merchant grade phosphoric acid" U.S. Patent 4 721 519, Issue date: January 26, 1988
- ^ ”Super Phosphoric Acid 0-68-0 Material Safety Data Sheet”. J.R. Simplot Company. 1 maj 2009. Arkiverad från originalet den 16 juli 2011. https://web.archive.org/web/20110716072332/http://msds.simplot.com/datasheets/12002.pdf. Läst 4 maj 2010.
- ^ [a b] ”Fosforsyra”. Sök E-nummer. Livsmedelsverket. http://www.livsmedelsverket.se/livsmedel-och-innehall/tillsatser-e-nummer/sok-e-nummer/e-338---fosforsyra/. Läst 24 juli 2016.
- ^ Kemikalieinspektionen Arkiverad 7 december 2008 hämtat från the Wayback Machine.
- ^ Bra Böckers lexikon, 1977


