Polär molekyl
En polär molekyl är en molekyl som är övervägande positiv i minst en ände och negativ i andra. Sådana molekyler sägs ha ett dipol- eller multipolmoment. Dipolmomentet används som mått på deras polaritet.
Elektronegativitet[redigera | redigera wikitext]
En polär molekyl måste innehålla en skillnad i elektronegativitet mellan dess atomer. Alla atomer har en viss elektronegativitet. Denna beskriver hur starkt atomen drar till sig elektroner och alla atomer gör detta med olika kraft. Pauling-Skalan är det mest använda systemet för att värdera denna elektronegativitet hos atomer.[1] På grund av elektronernas laddning så tenderar atomer med hög elektronegativitet att bli negativt laddade. Atomer som i stället har låg elektronegativitet attraherar inte elektroner med samma kraft inuti molekyler och blir därmed positivt laddade. En polär molekyl har en positiv och negativ ända. För att detta ska ske måste atomen eller atomerna i den negativa ändan vara högre elektronegativa än de i den andra.[2]
Lösningsförmåga i olika ämnen[redigera | redigera wikitext]
Polära ämnen är lösliga i andra polära ämnen, och nästan helt olösliga i opolära föreningar. Detta sker på grund av att ämnen med lika egenskaper kan binda till varandra. För att kemiska föreningar ska lösas, måste det uppstå bindningar mellan dem. Polära molekyler har en skillnad i elektronegativitet bland atomer och gör att det finns olika laddningar i föreningarna. De intermolekylära bindningarna mellan polära ämnen kan variera beroende på dess egenskaper. De främsta bindningar mellan dessa molekyler är dipol-dipol bindningar och vätebindningar. Dipol-dipol bindningar uppstår mellan två dipoler. Den negativt laddade ändan binder med den andra föreningens positiva ända. Detta sker då laddningarna attraherar varandra. Molekyler som är dipoler är polära vilket gör denna typ av lösning möjlig för polära ämnen.[3] Vätebindningar uppstår också bland vissa polära molekyler. En vätebindning är en starkare dipolbindning där väte i den ena föreningen binder till ett starkt elektronegativt grundämne, exempelvis syre, men sedan även till en stark elektronegativ atom i den andra föreningen. Dessa bindningar gör att polära molekyler kan lösas med varandra. Opolära ämnen däremot, har ingen större skillnad i laddning. De kan därför inte binda på samma sätt som polära föreningar. Den primära intermolekylära bindningen för opolära ämnen är van der Waals bindningar. På grund av skillnaden i egenskaper bland polära och opolära molekyler uppstår sällan bindningar mellan dem och därför är de svårlösliga.[4]
Intramolekylära bindningar[redigera | redigera wikitext]
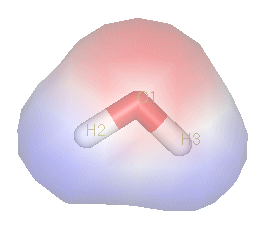
Polära molekyler innehåller polära kovalenta bindningar och/eller joniserade grupper. En polärt kovalent bindning är intramolekylär och uppstår mellan atomer med olika elektronegativitet. Tillskillnad från vanlig kovalent bindning, så innebär grundämnenas olika dragningskraft en ojämn fördelning av elektroner. Istället för att elektronerna spenderar lika mycket tid hos atomerna i den kovalenta bindningen så befinner de sig mest där elektronegativiteten är högst. Elektronernas negativa laddning skapar sedan påverkan på molekylens egenskaper. Om elektroner dras mer till en av atomerna i en kemisk förening så kommer den sida av molekylen bli mer negativt laddad.[5] Ett exempel på en sådan förening är vatten, H2O. Grundämnet väte har ett elektronegativt värde på 2,2 och syre har ett värde på 3,44, båda dessa enligt Pauling-Skalan. Skillnaden i elektronegativitet gör att en polärt kovalent bindning uppstår mellan väteatomerna och syret. Eftersom syre attraherar elektroner med en högre kraft så kommer de laddade partiklar som binder ihop atomerna att dras till syre atomen. Syret i molekylen blir därmed negativt laddad medan underskottet av elektroner gör väteatomerna positiva. Vatten är inte en linjär molekyl då de två obundna elektronparen hos syret befinner sig på en sida av atomen. Väteatomerna binder därför bredvid varandra, men deras positiva laddning gör att de trycks i väg och skapar en böjd molekyl. Denna böj innebär att det finns en tydlig negativ och positiv ända i föreningen och gör vatten därmed till en polär molekyl.[6]
Motsatsen till polär är opolär.
Se även[redigera | redigera wikitext]
Källor[redigera | redigera wikitext]
- ^ ”Elektronegativitet - Naturvetenskap.org”. www.naturvetenskap.org. https://www.naturvetenskap.org/kemi/gymnasiekemi/kemiska-bindningar/elektronegativitet/. Läst 12 maj 2022.
- ^ ”Polar Molecules | Chemistry for Non-Majors”. courses.lumenlearning.com. https://courses.lumenlearning.com/cheminter/chapter/polar-molecules/. Läst 10 maj 2022.
- ^ ”Dipol-dipolbindning - Naturvetenskap.org”. www.naturvetenskap.org. https://www.naturvetenskap.org/kemi/gymnasiekemi/kemiska-bindningar/intermolekylara-bindningar/dipol-dipolbindning/. Läst 12 maj 2022.
- ^ Ehinger, Magnus (8 maj 2019). Katalys 1. Läst 11 maj 2022
- ^ ”Polar Covalent Bond - an overview | ScienceDirect Topics”. www.sciencedirect.com. https://www.sciencedirect.com/topics/chemistry/polar-covalent-bond. Läst 12 maj 2022.
- ^ ”15.1: Structure of Water” (på engelska). Chemistry LibreTexts. 27 juni 2016. https://chem.libretexts.org/Bookshelves/Introductory_Chemistry/Introductory_Chemistry_(CK-12)/15%3A_Water/15.01%3A_Structure_of_Water. Läst 12 maj 2022.
