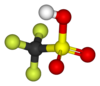
Trifluormetansulfonsyra
| Trifluormetansulfonsyra | |
  | |
| Systematiskt namn | Trifluormetansulfonsyra |
|---|---|
| Övriga namn | Triflatsyra, HOTf, TfOH |
| Kemisk formel | CF3SO2OH |
| Molmassa | 150,08 g/mol |
| Utseende | Färglös vätska |
| CAS-nummer | 1493-13-6 |
| SMILES | FC(F)(F)S(=O)(=O)O |
| Egenskaper | |
| Densitet | 1,696 g/cm³ |
| Löslighet (vatten) | Blandbar |
| Smältpunkt | -40 °C |
| Kokpunkt | 162 °C |
| Faror | |
| Huvudfara | |
| LD50 | 1605 mg/kg |
| SI-enheter & STP används om ej annat angivits | |
Trifluormetansulfonsyra, även känt som HOTf eller TfOH (där -OTf eller TfO- betecknar triflatgruppen) är en sulfonsyra med kemisk formel CF3SO2OH. Ämnet betraktas ofta som en av de starkaste syrorna, och är en av de så kallade "supersyrorna". Ämnet används flitigt både som katalysator och som reaktant i organisk kemi. Syrans salter kallas triflater.
Egenskaper[redigera | redigera wikitext]
Trifluormetansulfonsyra är en hygroskopisk, färglös vätska vid rumstemperatur. Ämnet löser sig i polära lösningsmedel så som (CH3)2NC(O)H (dimetylformamid), (CH3)2SO (dimetylsulfoxid), CH3CN (acetonitril) och (CH3)2SO2 (dimetylsulfon). Tillägg av trifluormetansulfonsyra till polära lösningsmedel kan vara farligt exotermt.
Historia och syntes[redigera | redigera wikitext]
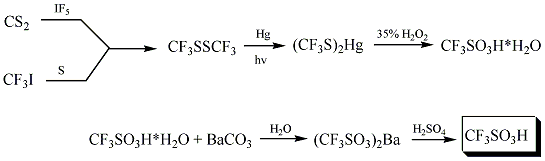
Trifluormetansulfonsyra syntetiserades för första gången år 1954 av R. N. Haszeldine och J. M. Kidd enligt följande reaktion:
Referenser[redigera | redigera wikitext]
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Trifluoromethanesulfonic acid, 5 oktober 2009.