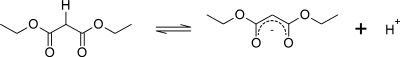Dietylmalonat
| Dietylmalonat | |
 | |
| Systematiskt namn | Diethyl malonate[1] |
|---|---|
| Kemisk formel | C7H12 O4 |
| Molmassa | 160,17 g/mol |
| Utseende | Färglös vätska |
| CAS-nummer | 105-53-3 |
| SMILES | O=C(OCC)CC(=O)OCC |
| Egenskaper | |
| Densitet | 1,05 g/cm³ |
| Löslighet (vatten) | Försumbar |
| Smältpunkt | -50 °C |
| Kokpunkt | 199 °C |
| Faror | |
| Huvudfara | Skadligt (X), brandfarligt (F) |
| SI-enheter & STP används om ej annat angivits | |
Dietylmalonat, även dietylpropandioat[2] är en dietylester som framställs av malonsyra. Den förekommer naturligt i druvor och jordgubbar som en färglös vätska med en äppelliknande lukt och används i parfymer. Dess användbarhet kommer sig av den aktiverade metylengruppen (CH2), som kan deprotoneras och agera nukleofil. Dietylmalonat används också vid framställningen av konstgjorda smakämnen, B1- och B6-vitamin och barbiturater.
Egenskaper[redigera | redigera wikitext]
Malonsyra är en ganska enkel dikarboxylsyra, med två karboxylgrupperna nära varandra. Vid bildning av dietylmalonat från malonsyra ersätts hydroxylgruppen (−OH) på båda karboxylgrupperna med en etoxigrupp (−OEt; −OCH2CH3). Metylengruppen (−CH2−) i mitten av den maloniska delen av dietylmalonatmolekylen gränsar till två karbonylgrupper (−C(=O)−).[3]
Väteatomerna på kolet intill karbonylgruppen i en molekyl är signifikant surare än väteatomer på ett kol intill alkylgrupper (upp till 30 storleksordningar). (Detta är känt som α-positionen med avseende på karbonylen.) Väteatomerna på ett kol intill två karbonylgrupper är ännu surare eftersom karbonylgrupperna hjälper till att stabilisera karbanjonen som härrör från avlägsnandet av en proton från metylengruppen mellan dem.
Omfattningen av resonansstabilisering av denna förenings konjugatbas avbildas av de tre resonansformerna nedan:
Framställning[redigera | redigera wikitext]
Dietylmalonat kan framställas genom att natriumsaltet av klorättiksyra reagerar med natriumcyanid, följt av bashydrolys av den resulterande nitrilen för att ge natriumsaltet av äppelsyran. Fischer-förestring ger dietylmalonat:
Reaktioner[redigera | redigera wikitext]
Malonisk estersyntes[redigera | redigera wikitext]
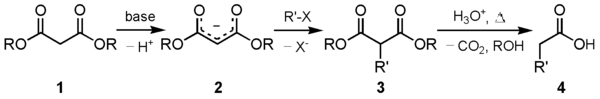
En av de viktigaste användningarna av denna förening används i den maloniska estersyntesen. Karbanjonen (2) som bildas genom att reagera dietylmalonat (1) med en lämplig bas kan alkyleras med en lämplig elektrofil. Denna alkylerade 1,3-dikarbonylförening (3) genomgår lätt dekarboxylering med avgång av koldioxid för att ge en substituerad ättiksyra (4):
I allmänhet föredras salter av alkoxidanjonen vars alkyldel motsvarar den som används i ovanstående alkylering som bas. Användningen av en konventionell bas kan ge bashydrolysprodukter – till exempel skulle natriumhydroxid helt enkelt producera natriummalonat och alkoholen, medan andra alkoxidsalter kommer att orsaka scrambling genom transesterifiering. Endast den "samma" alkoxidanjonen som den som man använde för att alkylera det deprotonerade aktiva metyleniska stället kommer att förhindra både bashydrolys och transesterifiering.
Andra reaktioner[redigera | redigera wikitext]
Liksom många andra estrar genomgår denna förening Claisen-esterkondensationerna. Fördelen med att använda denna förening är att oönskade självkondensationsreaktioner undviks. Liksom andra estrar genomgår denna förening bromination vid alfapositionen.[4]
Dietylmalonat kan nitroseras med överskott av natriumnitrit i ättiksyra för att ge dietyloximinomalonat, katalytisk hydrogenolys av vilken i etanol över Pd/C ger dietylaminomalonat (DEAM). DEAM kan acetyleras för att producera dietylacetamidomalonat (användbart vid aminosyrasyntes), eller kan tillsättas med 3-substituerade 2,4-diketoner till kokande ättiksyra för att ge maximal avkastning olika substituerade etylpyrrol-2-karboxylater av intresse för porfyrinsyntes.[5]
Referenser[redigera | redigera wikitext]
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Diethyl malonate, 26 maj 2022.
Noter[redigera | redigera wikitext]
- ^ 'malonic acid' is recognised as a valid, expert-verified name for what would systematically be called 'propanedioic acid' according to ChemSpider.
- ^ Organisk nomenklatur Arkiverad 10 januari 2021 hämtat från the Wayback Machine., Kemiska institutionen, Lunds Universitet (
 PDF) Sid.26
PDF) Sid.26
- ^ ”IR spectrum of Malonic acid”. IR spectrum of Malonic acid. http://wwwchem.csustan.edu/Tutorials/images/irunk05.gif. ”Arkiverade kopian”. Arkiverad från originalet den 26 juni 2010. https://web.archive.org/web/20100626050637/http://wwwchem.csustan.edu/Tutorials/images/irunk05.gif. Läst 6 november 2022.
- ^ C. S. Palmer and P. W. McWherter. "Ethyl Bromomalonate". Organic Syntheses.; Collective Volume, vol. 1, p. 245
- ^ Paine, John B.; Dolphin, David (1985-12-01). ”Pyrrole chemistry. An improved synthesis of ethyl pyrrole-2-carboxylate esters from diethyl aminomalonate”. The Journal of Organic Chemistry 50 (26): sid. 5598–5604. doi:. ISSN 0022-3263. https://doi.org/10.1021/jo00350a033.
Externa länkar[redigera | redigera wikitext]
 Wikimedia Commons har media som rör Dietylmalonat.
Wikimedia Commons har media som rör Dietylmalonat.