Adiabatisk flamtemperatur

Adiabatisk flamtemperatur är den temperatur som blir resultatet av förbränning under idealiska förhållanden där ingen värmeenergi eller mekanisk energi utväxlas med omgivningen. Det finns två typer av adiabatisk flamtemperatur: konstant volym och konstant tryck, beroende på hur processen slutförs. Vid konstanta volymen är adiabatisk flamtemperatur den temperatur som är resultatet av en fullständig förbränningsprocess som sker utan arbete, värmeöverföring eller förändringar i kinetisk eller potentiell energi. Dess temperatur är högre än i konstanttrycksprocessen eftersom ingen energi används för att ändra systemets volym (det vill säga generera arbete).
Vanliga lågor[redigera | redigera wikitext]
I det dagliga livet är huvuddelen av lågor man möter de som orsakas av snabb oxidering av kolväten i material som trä, vax, fett, plast, propan och bensin. Den adiabatiska flamtemperaturen med konstant tryck för sådana ämnen i luft ligger i ett relativt snävt område runt 1 950 °C. Detta beror mest på att förbränningsvärmen av dessa föreningar är ungefär proportionell mot mängden syre som förbrukas, vilket proportionellt ökar mängden luft som måste värmas, så effekten av en större förbränningsvärme på flamtemperaturen kompenseras. Ofullständig reaktion vid högre temperatur minskar ytterligare effekten av en större förbränningsvärme.
Eftersom de flesta förbränningsprocesser som sker naturligt sker i det fria, finns det inget som begränsar gasen till en viss volym som cylindern i en motor. Som ett resultat kommer dessa ämnen att brinna vid ett konstant tryck, vilket gör att gasen kan expandera under processen.
Vanliga lågtemperaturer[redigera | redigera wikitext]
Om man antar initiala atmosfäriska förhållanden (1 bar och 20 °C), visar följande tabell[1] flamtemperaturen för olika bränslen under konstanta tryckförhållanden. De temperaturer som nämns här är för en stökiometrisk bränsle-oxidationsmedelsblandning (det vill säga ekvivalensförhållande φ = 1).
Observera att detta är teoretiska, inte faktiska, lågtemperaturer som produceras av en låga som inte förlorar någon värme. Den närmaste kommer att vara den hetaste delen av en låga, där förbränningsreaktionen är mest effektiv. Detta förutsätter också fullständig förbränning (till exempel perfekt balanserad, rökfri, vanligtvis blåaktig låga). Flera värden i tabellen stämmer väsentligt inte överens med litteraturen[1] eller förutsägelser från onlinemätare.
| Bränsle | Oxidator 1 bar 20 °C |
||
|---|---|---|---|
| (°C) | (°F) | ||
| Acetylen (C2H2) | Luft | 2500 | 4532 |
| Syre | 3480 | 6296 | |
| Butan (C4H10) | Air | 2231 | 4074[2] |
| Cyanogen (C2N2) | Syre | 4525 | 8177 |
| Dicyanoacetylen (C4N2) | Syre | 4990 | 9010 |
| Etan (C2H6) | Luft | 1955 | 3551 |
| Etanol (C2H5OH) | Luft | 2082 | 3779[3] |
| Bensin | Luft | 2138 | 3880[3] |
| Vätgas (H2) | Luft | 2254 | 4089[3] |
| Magnesium (Mg) | Luft | 1982 | 3600[4] |
| Metan (CH4) | Luft | 1963 | 3565[5] |
| Metanol (CH3OH) | Luft | 1949 | 3540[5] |
| Nafta | Luft | 2533 | 4591[2] |
| Naturgas | Luft | 1960 | 3562[6] |
| Pentan (C5H12) | Luft | 1977 | 3591[5] |
| Propan (C3H8) | Luft | 1980 | 3596[7] |
| Metylacetylen (CH3CCH) |
Luft | 2010 | 3650 |
| Syre | 2927 | 5301 | |
| Toluen (C7H8) | Luft | 2071 | 3760[5] |
| Trä | Luft | 1980 | 3596 |
| Fotogen | Luft | 2093[8] | 3801 |
| Lätt eldningsolja | Luft | 2104[8] | 3820 |
| Medium eldningsolja | Luft | 2101[8] | 3815 |
| Tung eldningsolja | Luft | 2102[8] | 3817 |
| Bituminöst kol | Luft | 2172[8] | 3943 |
| Antracit | Luft | 2180[8] | 3957 |
| Syre | ≈3500[9] | ≈6332 | |
| Aluminium | Syre | 3732 | 6750[5] |
| Litium | Syre | 2438 | 4420[5] |
| Fosfor (vit) | Syre | 2969 | 5376[5] |
| Zirkonium | Syre | 4005 | 7241[5] |
Termodynamik[redigera | redigera wikitext]
Från termodynamikens första lag för ett slutet reagerande system har vi
där, och är värmen respektive arbetet som överförs från systemet till omgivningen under processen, och och är den inre energin hos reaktanterna respektive produkterna. I fallet med konstant volym av adiabatisk flamtemperatur hålls systemets volym konstant och därför sker inget arbete:
Det finns heller ingen värmeöverföring eftersom processen definieras som adiabatisk: . Som ett resultat är produkternas inre energi lika med reaktanternas inre energi: . Eftersom detta är ett slutet system är massan av produkterna och reaktanterna konstant och den första lagen kan skrivas på massabasis,
- .

I fallet med konstant tryck adiabatisk flamtemperatur hålls systemets tryck konstant, vilket resulterar i följande ekvation för arbetet:
Återigen sker ingen värmeöverföring eftersom processen definieras som adiabatisk: . Från den första lagen finner vi att,
Definitionen av entalpi ges av . Eftersom detta är ett slutet system är massan av produkterna och reaktanterna densamma och den första lagen kan skrivas på massbasis:
- .
Det framgår härav att den adiabatiska flamtemperaturen för processen med konstant tryck är lägre än den för processen med konstant volym. Detta beror på att en del av den energi som frigörs vid förbränning går, som arbete, till att ändra volymen på styrsystemet.
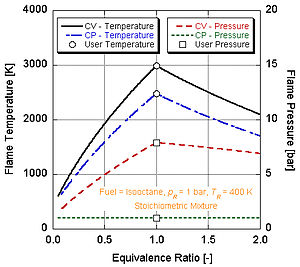
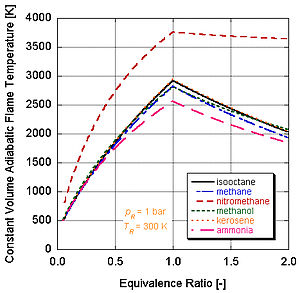
Görs antagandet att förbränningen slutförs (det vill säga bildar bara CO2 och H2O), kan den adiabatiska flamtemperaturen beräknas för hand antingen vid stökiometriska förhållanden eller mager av stökiometri (överskott av luft). Detta beror på att det finns tillräckligt med variabler och molära ekvationer för att balansera vänster och höger sida,
Rik på stökiometri finns det inte tillräckligt med variabler eftersom förbränningen inte kan fullföljas med åtminstone CO och H2 behövs för molarbalansen (detta är de vanligaste produkterna av ofullständig förbränning),
Om vattengasförskjutningsreaktionen inkluderas,
och jämviktskonstanten används för denna reaktion, kommer vi att ha tillräckligt med variabler för att slutföra beräkningen.
Olika bränslen med olika nivåer av energi och molära beståndsdelar kommer att ha olika adiabatisk flamtemperatur.
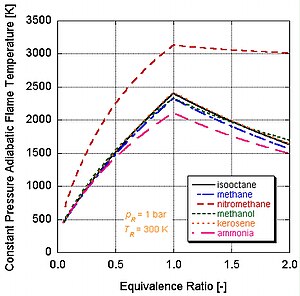
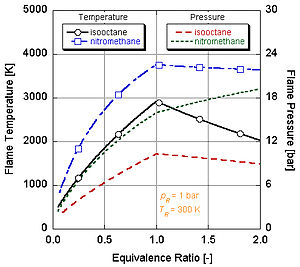
Det framgår av följande figur varför nitrometan (CH3NO) ofta används som en krafthöjning för bilmotorer. Eftersom varje molekyl av nitrometan innehåller en oxidant med relativt hög energibindningar mellan kväve och syre, kan den brinna med mycket högre temperatur än kolväten eller syrehaltig metanol. Detta är analogt med att tillsätta rent syre, vilket också höjer den adiabatiska flamtemperaturen. Detta i sin tur gör att den kan bygga upp mer tryck under en konstant volymprocess. Ju högre tryck, desto mer kraft på kolven skapar mer arbete och mer kraft i motorn. Den förblir relativt varm och rik på stökiometri eftersom den innehåller sin egen oxidant. Men kontinuerlig drift av en motor på nitrometan kommer så småningom att smälta kolven och/eller cylindern på grund av denna högre temperatur.

I verkliga tillämpningar sker i allmänet icke fullständig förbränning. Kemi ger att dissociation och kinetik kommer att förändra produktens sammansättning. Det finns ett antal program tillgängliga som kan beräkna den adiabatiska flamtemperaturen med hänsyn till dissociation genom jämviktskonstanter (Stanjan, NASA CEA, AFTP).
Referenser[redigera | redigera wikitext]
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Adiabatic flame temperature, 19 juni 2023.
Noter[redigera | redigera wikitext]
- ^ [a b] See under "Tables" in the external references below.
- ^ [a b] Libal, Angela (27 april 2018). ”What Temperatures Do Lighters Burn At?”. Sciencing. Leaf Group Ltd. / Leaf Group Media. https://sciencing.com/temperatures-do-lighters-burn-8475271.html.
- ^ [a b c] Flame Temperature Analysis and NOx Emissions for Different Fuels
- ^ ”How hot does magnesium burn? | Reference.com”. Arkiverad från originalet den 17 september 2017. https://web.archive.org/web/20170917172054/https://www.reference.com/science/hot-magnesium-burn-b65985ed030138e7. Läst 17 september 2017.
- ^ [a b c d e f g h] CRC Handbook of Chemistry and Physics, 96th Edition, p. 15-51
- ^ ”North American Combustion Handbook, Volume 1, 3rd edition, North American Mfg Co., 1986.”. Arkiverad från originalet den 16 juli 2011. https://web.archive.org/web/20110716024101/http://www.uniongas.com/aboutus/aboutng/composition.asp. Läst 9 december 2009.
- ^ ”Flame Temperature Measurement Experiment”. Arkiverad från originalet den 24 september 2015. https://web.archive.org/web/20150924092312/http://www.rpgroup.caltech.edu/courses/me96/flame2003.pdf. Läst 19 maj 2013.
- ^ [a b c d e f] Hsin Chu. ”Power Point Presentation: Flame Temperature”. Department of Environmental Engineering, National Cheng Kung University, Taiwan. Arkiverad från originalet den 17 juli 2011. https://web.archive.org/web/20110717210941/http://myweb.ncku.edu.tw/~chuhsin/ppt/combustion%20principles%20and%20control/04-Flame%20Temperature.ppt.
- ^ Analysis of oxy-fuel combustion power cycle utilizing a pressurized coal combustor by Jongsup Hong et al., MIT, which cites IPCC Special Report on Carbon Dioxide Capture and Storage. Intergovernmental Panel on Climate Change. 2005. sid. 122. https://www.ipcc.ch/site/assets/uploads/2018/03/srccs_wholereport-1.pdf. But the IPCC report actually gives a much less precise statement: "The direct combustion of fuel and oxygen has been practised for many years in the metallurgical and glass industries where burners operate at near stoichiometric conditions with flame temperatures of up to 3500°C." The temperature may depend on pressure, because at lower pressure there will be more dissociation of the combustion products, implying a lower adiabatic temperature.
Externa länkar[redigera | redigera wikitext]
Allmän information[redigera | redigera wikitext]
- Babrauskas, Vytenis (25 februari 2006). ”Temperatures in flames and fires”. Fire Science and Technology Inc.. Arkiverad från originalet den 12 januari 2008. https://web.archive.org/web/20080112141325/http://www.doctorfire.com/flametmp.html. Läst 27 januari 2008.
Tabeller[redigera | redigera wikitext]
- ”Adiabatic Flame Temperature”. The Engineering Toolbox. Arkiverad från originalet den 28 januari 2008. https://web.archive.org/web/20080128053804/http://www.engineeringtoolbox.com/adiabatic-flame-temperature-d_996.html. Läst 27 januari 2008. adiabatic flame temperature of hydrogen, methane, propane and octane with oxygen or air as oxidizers
- ”Flame Temperatures for some Common Gases”. The Engineering Toolbox. Arkiverad från originalet den 7 januari 2008. https://web.archive.org/web/20080107164751/http://www.engineeringtoolbox.com/flame-temperatures-gases-d_422.html. Läst 27 januari 2008.
- Temperature of a blue flame and common materials
Kalkylatorer[redigera | redigera wikitext]
- Online adiabatic flame temperature calculator using Cantera
- Adiabatic flame temperature program
- Gaseq, program for performing chemical equilibrium calculations.
- Flame Temperature Calculator - Constant pressure bipropellant adiabatic combustion
- Adiabatic Flame Temperature calculator

















