Bakteriofagterapi
Bakteriofagterapi, vidare refererat som fagterapi, innebär en terapeutisk användning av specifika bakteriofager, vidare refererat som fager, vilka är virus som verkar mot specifika bakterier. Då fager har möjlighet att på ett effektivt sätt ta död på bakterier kan denna typ av behandling vara av stort medicinskt värde inte minst vad gäller antibiotikaresistenta bakterier.[1] Även om fagterapi använts på människor i vissa östeuropeiska länder under nästan ett sekel samt att behandlingen nyligen fått viss spridning till andra länder såsom USA och Frankrike,[1] återstår mycket forskning för att fagterapin ska kunna etableras på en större marknad.[2] Utöver den potentiella användningen för behandling av människor, som denna artikel främst avser, används fagterapi av veterinärer samt inom matindustrin.[3]

Historik[redigera | redigera wikitext]

Fager upptäcktes 1915 av Frederick Twort men det var Félix d'Herelle som 1919 fick idén att använda dessa virus vid behandling av bakterieinfektioner hos människor. Det första försöket han gjorde var på dysenteri.[4] Trots flera lyckade försök var d'Hérelle känd för att utföra sina experiment okontrollerat och det var flera inom det vetenskapliga samhället som talade negativt om honom. 1931 gjorde d'Hérelle ett försök att använda fagterapi för att bota kolera. Resultatet blev 90 procents minskad dödlighet.[5]

Det var även flera forskare från Brasilien och USA som under Félix tid försökte förmedla information angående fagterapi samt fortsatte att forska vidare inom området. Preparaten de forskade fram skickades ut till de testkliniker i världen som ville testa den nya behandlingen. Resultatet blev väldigt blandat vilket visade att fagterapi ännu var för instabilt för att säkert kunna användas. Många misstag gjordes under de tidiga försöken, mycket beroende på kunskapsbrist angående fagers biologi. På grund av dålig rengöring samt dålig förvaring blev koncentrationen av aktiva fager låg och de blev även förorenade av antigener. Detta blev en av anledningarna till att fagterapin lades på is när antibiotikan utvecklades.[5]
Antibiotika har länge kunnat bota oss från många infektionssjukdomar. Idag är ett av våra största hot inom vården antibiotikaresistenta bakterier. Efter 2050 beräknas 10 miljoner människor dö varje år på grund av antibiotikaresistens. Detta beror på att man inte har använt antibiotika speciellt sparsamt. Ju mer antibiotika som används, desto fler resistenta bakterier kommer man möta i framtiden.[6] Eftersom bakterierna idag utvecklar resistens mot nya antibiotika snabbare än tidigare är det svårt att tjäna pengar på att utveckla nya typer av antibiotika. 1983–1987 godkändes 16 nya antibiotika för användning i USA. 2010–2016 godkändes endast 6 stycken. Om inte läkemedelsföretagen kan tjäna pengar på sina preparat är det inte värt för dem att tillverka samt forska för att utveckla nya antibiotika. En lösning på detta problem kan vara fagterapi.[5] 2001–2011 ökade antalet artiklar i PubMed med sökordet "phage therapy" i titeln med 800 procent.[7]
Under 1930-talet producerade Eli Lilly minst sju olika fagprodukter som kunde bota tillstånd som bölder, sår och luftvägsinfektioner. The American Medical Association’s Council on Pharmacy and Chemistry report 1934 visade en oro för att fagernas biologi och uppbyggnad inte var klarställd. Det var inte förrän 1940 som det med hjälp av elektronmikroskop gick att fastställa fagernas uppbyggnad och biologi så att den moderna forskningen på ämnet kunde påbörjas.[8]
Global användning av fager[redigera | redigera wikitext]
Eliava Institute grundades 1923 av George Eliava och är ett institut som fokuserar på forskning inom bland annat fagterapi.[9] Georgien är idag ett av de länder som använder fagterapi i den allmänna vården. Eliava Institute forskar på att försöka förbättra de traditionella fagterapiblandningarna för att kunna använda dem mot fler sjukdomar som till exempel prostatit och cystisk fibros. Under 1980-talet skapade de 1200 anställda två ton fagprodukter. De flesta var tabletter och flytande preparat mot dysenteri, men också mot sjukdomar som till exempel kallbrand. 80 procent av preparaten användes av den sovjetiska armén. När Sovjetunionen bröts upp i början av 1990-talet blev det svårt för institutet att klara sig ekonomiskt men 1995 blev det privatägt och de kunde åter fortsätta sin forskning.[3]
Det huvudsakliga målet för det brittiska fagterapiföretaget, Biocontrol Limited, är att bota kronisk otitis (öroninflammation). Dessa bakterier är ofta väl skyddade och därför svåra att komma åt för både antibiotika och immunceller. Biocontrol Limited gjorde ett lyckat försök att bota öroninflammation hos hundar med hjälp av fagterapi.[3]
En grupp belgiska forskare och kirurger har länge varit intresserade av att framförallt använda fagterapi på brännskador. Det har varit stor framgång inom medicinering av brännskador de senaste åren, men infektioner är fortfarande ett stort problem. De få undersökningar som gjorts på brännskador samt sår antyder att fagterapi är ett alternativ för att bota dessa infektioner.[3]
The Hirszfeld Institute of Immunology and Experimental Therapy i Polen är ett institut som länge har arbetat med fager. De har hjälpt lokala läkare med antibiotikaresistenta patienter samt regelbundet publicerat resultat från sin forskning sedan 1980-talet. 2005 etablerade institutet sin egen fagterapiklinik och har därför nu möjlighet att göra fler formella försök.[3]
Fagers påverkan på bakterier och människor[redigera | redigera wikitext]
Fagers påverkan på eukaryota celler och bakterier[redigera | redigera wikitext]
Eukaryota celler kan inte infekteras av fager på samma sätt som de infekterar bakterier, något som är till fördel vid fagterapi. Detta på grund av de stora skillnader som finns mellan eukaryota celler och bakterier, främst med avseende på cellyte-receptorer och intracellulärt maskineri.[10] Fager kan dock vara närvarande i eukaryota celler vilket har observerats hos människan, bland annat i urinvägarna och i blodet. Mekanismen bakom detta och på vilket sätt fager påverkar dessa celler är ännu inte helt utrett.[10]
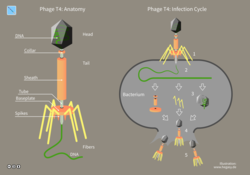
Bakterier har på sin yta receptorer, specifika för varje art, vilka möjliggör för bakterien att känna av olika kemiska ämnen såsom näring och gifter.[11] Dessa receptorer kan fager binda till och då injicera sitt DNA i bakterien och infektera denna.[12] När fagens DNA är inne i bakterien läses det av med hjälp av bakteriens eget transkriptionssystem. Detta resulterar i att proteiner skapas vilka möjliggör för fagen att ta kontroll över bakterien, som i sin tur får sin egen proteinsyntes störd. I fallet med fagen T4 (illustrerad i bilden bredvid) tar det cirka 25 minuter från det att fagen injicerat sitt DNA till dess att bakterien lyseras, varvid 100-200 nya fager frisläpps.[12] Beroende av vilken typ av fag som injicerar sitt DNA kan fagen:
- orsaka lysering av bakteriecellen, så kallade lytiska fager, vilket är en önskvärd egenskap vid fagterapi; se "Fager för fagterapi" nedan.
- samexistera med värdbakterien till dess att bakteriens miljö försämras, varvid fagen börjar replikera och lysera dess värd, så kallade temperata fager.[12]
För att bakterien ska kunna skydda sig mot specifika fager har de utvecklat olika strategier för att motverka faginfektion. Detta inbegriper bland annat modifiering av de fagbindande receptorerna.[13] Denna modifiering kan dock vara kostsam för bakterien, vilket kan leda till förlorad möjlighet att känna igen vissa kemiska ämnen. Detta leder till en kapprustning som innebär att fagerna ständigt måste utvecklas för att möjliggöra inbindning till bakteriens nya receptorer. Detta kan vara av stor betydelse för förståelsen över huruvida bakterierna kan skapa resistens mot fagerna eller inte.[14] På området gällande hur fager binder till receptorer återstår mycket forskning för att klargöra faktorer och olika proteiners betydelse i denna process. Detta är av stor vikt att förstå i de fall där fagterapi ska nyttjas på ett storskaligt plan.[15]
Fagers påverkan på människor[redigera | redigera wikitext]
Människan är koloniserad av ett stort antal olika typer av mikroorganismer, vilka bildar vårt mikrobiom. Till detta hör bakterier, svampar, protister samt virus, där gruppen fager ingår, vilka genom selektivt tryck kan påverka bakterier och därmed människans biom.[10] Precis som varje individ har sin unika sammansättning av bakterier har varje individ sin egen unika uppsättning fager, så kallat fagom (eng. phageome).[16] Bakterier är av stor betydelse för vår hälsa, både genom att exempelvis producera viktiga vitaminer, steroidhormoner och neurotransmittorer,[17] samt orsaka sjukdomar. Fager påverkar således även vår hälsa genom att styra och avdöda specifika bakteriestammar.[10] Exakt på vilket sätt fager påverkar människans biom och huruvida de kan användas som en indikator för hälsotillstånd är något som diskuteras och forskas på, men mycket återstår innan vi till fullo kan förstå helheten för detta komplexa område.[16] Ny forskning indikerar även att fager kan ha en direkt påverkan både i det medfödda och det adaptiva immunförsvaret.[2] Forskare har tidigare trott att fager inte haft någon direkt inverkan på människans immunförsvar utan att fager påverkat detta endast genom indirekt påverkan genom bakterier. Det ska dock påpekas att detta är ett relativt nytt forskningsområde och mer data behövs för att kunna fastställa omfattningen av fagers påverkan på människans immunförsvar.[2]
Fager för fagterapi[redigera | redigera wikitext]
Fager kännetecknas av deras värdspecificitet[18] och det är bland annat det som avgör deras användbarhet inom fagterapi. De flesta fager infekterar bara ett fåtal bakteriestammar inom samma art och har därmed en smal värdspecificitet, medan andra infekterar flera stammar och har därmed en bredare värdspecificitet.[19] Ur ett praktiskt perspektiv kan de fager som har en bredare värdspecificitet erbjuda större fördelar inom fagterapi.[18] Några få fager kan även infektera fler än en art, så kallade polyvalenta fager.[19] Vilken värd fagen infekterar undersöks efter att den har isolerats.
Insamling av fager[redigera | redigera wikitext]
Den vanligaste metoden för isolering av fager är fortfarande densamma som Felix d´Herelle tog fram, metoden kallas berikningsprotokoll. Ett bakterieprov blandas med ett miljöprov och odlas, vanligtvis över natten. Bakterierna tas sedan bort från odlingen genom centrifugering eller filtrering. Närvaro av fager undersöks sedan i filtratet och de fager man hittar karaktäriseras för att avgöra om de har önskvärda egenskaper för användning inom fagterapi. Egenskaperna beror bland annat på virulens, värdspecificitet och om fagen har lytisk- eller andra livscyklar. Utifrån denna metod ser man stora variationer hos fagerna beroende på- (i) vilken typ av miljöprov som använts (ii) för-infektionsprocess (iii) isoleringsvärd och hur de kombineras med miljöprovet (iv) efter-infektionsprocess.[19]
Det bästa sättet att hitta fager är att leta där värden finns. Bland annat är det lätt att isolera fager för tarmbakterier hos däggdjur från fekalt material och i avlopp, medan man på huden och i sekret från en frisk hals kan hitta fager för bakterier som orsakar hudinfektioner. När det gäller fagterapi, då en fag för en särskild patogen är önskvärd, kan källan vara än mer specifik. Då kan de hittas i patienten själv eller i avloppsledningar som kommer från sjukhus.[19]

Egenskaper[redigera | redigera wikitext]
Av de fager som isoleras är det bara ett fåtal som har de rätta kriterierna som efterfrågas för fagterapi.[20] De önskvärda karaktäristiska egenskaperna som undersöks är:
(i) tillräckligt hög virulens. Fagernas förmåga att fullständigt lysera en bakterieodling är beroende av att de har högre virulens och produktivitet än målbakterierna, så att inte målbakterierna växer snabbare än fagerna kan döda dem. Muterade bakterier som är resistenta mot infektioner eller att dödas av fagerna, får bara finnas i lågt antal. Den resistenta populationen kan annars ta över fagpopulationen och fortsätta infektera patienten.
(ii) lytisk tillväxt eller avsaknad av lysogen förmåga.[19] Infektioner från lytiska fager leder till lysering, celldöd och att nya fagpartiklar frigörs.[21] I slutet på infektionscykeln har den lytiska fagen även möjlighet att avdöda antibiotikaresistenta bakterier.[20] Infektioner av temperata (lysogena) fager kan även det leda till lysering via lytisk replikation men detta händer inte alltid. Om fagens lytiska förmåga hämmas kommer samexistens mellan virusgenomet och värden inträffa. Det vanligaste är att fagens genom integreras i bakteriens kromosomer via lysogen replikation. Temperata fager används mycket sällan inom fagterapi på grund av att de inte dödar den infekterade bakterien till 100% och för att de kan innehålla gener som gör bakterien mer virulent, så kallad lysogen omvandling. Detta har kunnat observeras med många mänskliga patogener, exempelvis Vibrio cholerae, Escherichia coli och Clostridium botulinum.[18]
(iii) transduktionsförmåga. Fager med låg risk för transduktion är önskvärda inom fagterapi då detta annars kan medföra en risk att skadliga gener, till exempel gener för antibiotika resistens, överförs.[22]
(iv) brist på toxingener. Temperata fager kan vara bärare av toxingener, dessa kan verka som virulensfaktorer hos bakterier och öka förmågan att skapa en mer virulent patogen hos patienter som behandlas.[19]
(v) värdspecificitet, en viktig egenskap för att avgöra om en speciell fag är användbar för fagterapi. Desto bredare värdspecificitet inom en grupp av patogener desto större sannolikhet att fagen kan användas mot infektion av just den patogenen.[19]
Möjligheter och hinder[redigera | redigera wikitext]
Fager är högintressanta idag eftersom de kan användas som behandling vid infektioner orsakade av antibiotikaresistenta bakterier. Fagerna är väldigt specifika. Det gör att de endast avdödar bakterier av en viss bakteriestam och därmed är risken liten att de skadar människans gynnsamma tarmbakterier.[5] Fagerna förökar sig in vivo (i en levande organisms celler) och därför behövs bara en liten mängd användas från början. På så sätt ställs själva dosen in av fagerna själva. De förökar sig endast vid infektionsstället och slutar att föröka sig när deras värdbakterie är död.[23] Det skyddande lagret av polysackarider som biofilmbildande bakterier har, kan ofta penetreras av fager, medan detta är svårare för antibiotika.[24] Fager är en naturlig del av vår miljö men också känsliga för starkt solljus, höga temperaturer och torka. Det gör att de snabbt kan inaktiveras vid behov. Fager har därför mindre negativ påverkan på vår natur än till exempel bredspektrumantibiotika.[24]
Fager kan potentiellt sett framkalla ett immunsvar hos oss, men det verkar inte vara ett stort problem vid fagbehandling.[24] När bakterier dör släpps endotoxiner ut i den infekterades kropp. Detta kan ge symptom som feber och i värsta fall toxisk chock. Detta kan ske vid all avdödning av bakterier och är inte unikt för bakteriofager.[24] Genetisk manipulation av fager har visat sig kunna minska toxicitet och inflammatoriska reaktioner.[23] Inte alla fager är lämpliga för fagbehandling. Man strävar efter att använda lytiska fager med hög antibakteriell virulens och låg risk för transduktion, genöverföring från bakterie till fag. Temperata och toxinbärande fager undviks.[5]
Eftersom den specifika bakterie som orsakar en infektion inte alltid är känd, kan blandningar av fager användas, med olika kompletterande egenskaper, så kallade cocktails. De avdödar då de vanligaste bakteriestammarna och får på så sätt en större spännvidd. Detta är fördelaktigt då det kan ta lång tid att odla fram vilken bakterie som orsakar en infektion. Bakterier kan utveckla resistens mot fager, precis som mot antibiotika. Det finns en viss oro för att omfattande användning av fagcocktails skall leda till problem med resistensutveckling hos bakterier, alltså selektera fram bakteriestammar som är resistenta mot fager.[1]
I framtiden[redigera | redigera wikitext]
Trots rapporter av framgångsrika behandlingar från östeuropeiska länder är fagbehandling ännu inte tillgängligt i större delen av Västeuropa. Det beror främst på brist på tillämpliga regelverk och på en efterfrågan på in vivo studier i större omfattning. Studier där goda effekter och säkerhet kan visas. Det är en komplicerad process att få patent på terapeutiska fager. På grund av detta är läkemedelsföretag ovilliga att investera i forskning och kliniska tester. Forskare vid Stockholms universitet arbetar med att bygga upp en fagbank, ett bibliotek med bakteriofager, för framtida terapeutisk användning.[7] Det finns möjligheter att genetiskt modifiera fager och på så sätt ge dem förbättrade egenskaper, öka effektivitet och säkerhet. Det skulle då resultera i en patenterbar produkt som i sin tur skulle kunna få läkemedelsindustrin intresserad och locka investerare.[23]
Referenser[redigera | redigera wikitext]
- ^ [a b c] Örmälä, Anni-Maria; Jalasvuori, Matti (2013). ”Phage therapy”. Bacteriophage 3 (1). doi:.
- ^ [a b c] Van Belleghem, Jonas D.; Dąbrowska, Krystyna; Vaneechoutte, Mario; Barr, Jeremy J.; Bollyky, Paul L. (2018). ”Interactions between Bacteriophage, Bacteria, and the Mammalian Immune System”. Viruses 11(1): 10. doi:.
- ^ [a b c d e] Kutter, Elizabeth; De Vos, Daniel; Gvasalia, Guram; Alavidze, Zemphira; Gogokhia, Lasha; Kuhl, Sarah (2010). ”Phage Therapy in Clinical Practice: Treatment of Human Infections”. Current Pharmaceutical Biotechnology 11 (1): sid. 69–86. doi:.
- ^ Klein, Gunnar O. (2009). ”Fagterapi kan vara räddningen när antibiotika inte längre fungerar”. Läkartidningen 106 (40): sid. 2530-2532.
- ^ [a b c d e] Lin, Derek M.; Koskella, Britt; Lin, Henry C. (2017). ”Phage therapy: An alternative to antibiotics in the age of multi-drug resistance”. World Journal of Gastrointestinal Pharmacology and Therapeutics 8 (3): sid. 162–173. doi:.
- ^ Forskning.se (14 november 2016). Barkeman, Eva; Olsson, Carina. red. Antibiotikaresistens - vår tids största hot?. https://www.forskning.se/2016/11/14/antibiotikaresistens-var-tids-storsta-hot/. Läst 2 maj 2019.
- ^ [a b] "Bakteriofager slår direkt mot resistenta bakterier", Vetandets värld, Sveriges radio, 1 november 2011. Läst 1 november 2011.
- ^ Housby, John N.; Mann, Nicholas H. (2009). ”Phage Therapy”. Drug Discovery Today 14 (11-12): sid. 536-540. doi:.
- ^ Eliava Institute. ”About us”. Arkiverad från originalet den 15 april 2019. https://web.archive.org/web/20190415011734/http://eliava-institute.org/about-us/. Läst 18 april 2019.
- ^ [a b c d] Barr, Jeremy J. (2017). ”A bacteriophages journey through the human body”. Immunological Reviews 279 (1): sid. 106–122. doi:.
- ^ Bauman, Robert W. (2017). Microbiology. With diseases by taxonomy (5. ed.). Pearson education limited. sid. 86-123
- ^ [a b c] Bauman, Robert W. (2017). Microbiology. With diseases by taxonomy (5. ed). Pearson education limited. sid. 408-434
- ^ Azam, Haeruman; Tanji, Yasunori (2019). ”Bacteriophage-host arm race: an update on the mechanism of phage resistance in bacteria and revenge of the phage with the perspective for phage therapy”. Applied Microbiology and Biotechnology 103 (5): sid. 2121–2131. doi:.
- ^ Poullain, Virginie; Gandon, Sylvain; Brockhurst, Michael A.; Buckling, Angus; Hochberg, Michael E. (2008). ”The Evolution of Specificity in Evolving and Coevolving Antagonistic Interactions Between a Bacteria and Its Phage”. Evolution 62 (1): sid. 1–11. doi:.
- ^ Labrie, Simon J.; Samson, Julie E.; Moineau, Sylvain (2010). ”Bacteriophage resistance mechanisms”. Nature Reviews. Microbiology 8 (5): sid. 317–327. doi:.
- ^ [a b] Bakhshinejad, Babak; Ghiasvand, Saeedeh (2017). ”Bacteriophages in the human gut: Our fellow travelers throughout life and potential biomarkers of heath or disease”. Virus Research 240: sid. 47–55. doi:.
- ^ Blum, Hubert E. (2017). ”The human microbiome”. Advances in Medical Sciences 62 (2): sid. 414–420. doi:.
- ^ [a b c] Kropinski, Andrew M. (2006). ”Phage Therapy: Everything Old is New Again”. The Canadian Journal of Infectious Diseases & Medical Microbiology 17 (5): sid. 297–306. PMID 18382643.
- ^ [a b c d e f g] Hyman, Paul (2019). ”Phages for Phage Therapy: Isolation, Characterization, and Host Range Breadth”. Pharmaceuticals 12 (1). doi:.
- ^ [a b] Łobocka, Małgorzata; Hejnowicz, Monika S.; Hejnowicz, Urszula G.; Weber-Dąbrowska, Beata; Węgrzyn, Grzegorz; Dadlez, Michał (2014). ”The first step to bacteriophage therapy - How to choose the correct phage”. i Borysowski, Jan; Miedzybrodzki, Ryszard; Górski, Andrzej. Phage therapy : current research and applications. Norfolk UK: Caister Academic Press. https://www.caister.com/phagetherapy
- ^ Cisek, Agata A.; Dąbrowska, Iwona; Gregorczyk, Karolina P.; Wyżewski, Zbigniew (2017). ”Phage Therapy in Bacterial Infections Treatment: One Hundred Years After the Discovery of Bacteriophages”. Current Microbiology 74 (2): sid. 277–283. doi:.
- ^ Skurnik, Mikael (2018). ”Fagterapi”. Finska läkaresällskapets handlingar 178 (2): sid. 10-17. Arkiverad från originalet den 3 maj 2019. https://web.archive.org/web/20190503143226/https://www.fls.fi/Site/Data/884/Files/Handlingar-lehti_218_04.pdf. Läst 6 maj 2019.
- ^ [a b c] Azeredo, Joana; Kluskens, Leon D.; Costa, Ana R.; Nobrega, Franklin L. (2015). ”Revisiting phage therapy: new applications for old resources”. Trends in Microbiology 23 (4): sid. 185–191. doi:.
- ^ [a b c d] Loc-Carrillo, Catherine; Abedon, Stephen T. (2011). ”Pros and cons of phage therapy”. Bacteriophage 1 (2): sid. 111–114. doi:.
