Cyanamid
| Cyanamid | |
  | |
| Systematiskt namn | Cyanamid |
|---|---|
| Övriga namn | Aminonitril |
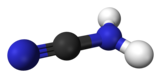
| Kemisk formel | CN2H2 |
| Molmassa | 42,04 g/mol |
| Utseende | Färglösa kristaller |
| CAS-nummer | 420-04-2 |
| SMILES | N#CN |
| Egenskaper | |
| Densitet | 1,28 g/cm³ |
| Löslighet (vatten) | 850 g/l (25 °C) |
| Smältpunkt | 44 °C |
| Kokpunkt | 260 °C (sönderfaller) |
| Faror | |
| Huvudfara | |
| NFPA 704 | |
| LD50 | 125 mg/kg (råtta) 150 mg/kg (kanin) 388 mg/kg (mus) |
| SI-enheter & STP används om ej annat angivits | |
Cyanamid är en amid av cyansyra med formeln CN2H2.[1]
Egenskaper[redigera | redigera wikitext]
Cyanamid har en struktur som liknar cyanväte, men är inte lika giftig. Den är en syra med pKa = 1,1[2] och kan bilda salter med alkalimetaller av vilka kalciumcyanamid (CaCN2) är den vanligaste.
Cyanamid är ett dehydrogeneringsmedel och kan driva kondensationsreaktioner.
Framställning[redigera | redigera wikitext]
Cyanamid framställs vanligen genom hydrolys av kalciumcyanamid.
Cyanamid kan också framställas genom att reagera cyanklorid (CNCl) med ammoniak (NH3).
Användning[redigera | redigera wikitext]
Cyanamid används främst för tillverkning av urea (CO(NH2)2) och tiourea (CS(NH2)2) genom reaktion med ett protiskt lösningsmedel som vatten eller svavelväte.
Se även[redigera | redigera wikitext]
Källor[redigera | redigera wikitext]
- ^ Safety data for cyanamide Arkiverad 11 juni 2010 hämtat från the Wayback Machine. Oxford University
- ^ pKa values index[död länk]
 Wikimedia Commons har media som rör Cyanamid.
Wikimedia Commons har media som rör Cyanamid.
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Cyanamide, tidigare version.
- Den här artikeln är helt eller delvis baserad på material från tyskspråkiga Wikipedia, Cyanamid, tidigare version.





