Metylmalonsyrauri
| Metylmalonsyrauri | |
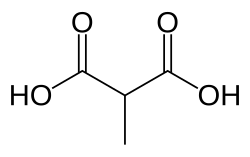 | |
| Klassifikation och externa resurser | |
|---|---|
| ICD-10 | E71.1 |
| ICD-9 | 270.3 |
| OMIM | 251000 251100 251110 277380 277400 277410 606169 |
| DiseasesDB | 29509 29510 |
| Medlineplus | 001162 |
| eMedicine | neuro/576 |
Metylmalonsyrauri[1] innebär förekomsten av metylmalonsyra i urinen. Den kan vara tillfällig pga B12-brist, eller livslång pga en ärftlig ämnesomsättningssjukdom som leder till att kroppen inte kan processa vissa proteiner och lipider normalt. Effekterna av sjukdomen uppkommer vanligtvis i tidig ålder och symptomen varierar från att vara milda till livshotande. Spädbarn kan uppleva uttorkning, kräkningar, förstorad lever (hepatomegali), hypotoni, ökat trötthet, problem med tillväxt och viktökning. De långsiktiga problem detta medför är bland annat problem med matintag, kronisk njursjukdom, inflammation i pankreas och intellektuella problem. Utebliven behandling kan i vissa fall leda till död. Sjukdomen drabbar ungefär en av 50.000–100.000 personer (USA).[2]
Metylmalonsyrauri är en komplex sjukdom där många genetiska och miljömässiga faktorer är kopplade till symptomen. Skadliga mutationer i MUT-, MMAA-, MMAB-, MMADHC- och MCEE-generna orsakar alla fall av metylmalonsyrauri. Effekterna av sjukdomen beror på vilken gen som är muterad och allvarlighetsgraden av mutationen. Mutationens påverkan på enzymet metylmalonyl-CoA-mutas avgör därför allvarlighetsgraden av sjukdomen.[2]
Ärftlighet[redigera | redigera wikitext]
Metylmalonsyrauri är en autosomalt recessiv metabol sjukdom vilket innebär att en individ med sjukdomen har mutationer i båda kopiorna av MUT genen, eller någon av de andra generna som kan orsaka sjukdomen. Friska föräldrar som är bärare på en muterad gen kopia kan därmed få ett sjukt barn om det nedärver båda föräldrarnas sjuka genkopia. Män och kvinnor drabbas lika frekvent.[3]
Mekanism[redigera | redigera wikitext]
Ungefär 60% av metylmalonsyrauri fallen orsakas av en mutation i MUT genen, vars produkt är med i bildningen av enzymet metylmalonyl-CoA-mutas. Detta enzym är aktivt i cellernas mitokondrier. Enzymet jobbar tillsammans med kobalamin (vitamin B12) för nedbrytning av lipider, kolesterol samt aminosyrorna metionin, threonin, isoleucin och valin. Mutationer i MUT genen påverkar både strukturen och mängden av metylmalonyl-CoA-mutas, vilket leder till att enzymet inte kan bryta ner dessa produkter som det borde. Defekten på metylmalonyl-CoA-mutas leder till att substansen metylmalonyl-CoA och andra eventuellt farliga ämnen kan byggas upp i organ och vävnader i kroppen. Den allvarligaste formen av metylmalonsyrauri kallas Mut0 och uppkommer om inget funktionellt metylmalonyl-CoA-mutas bildas.[2]
Genetik[redigera | redigera wikitext]
MUT ligger på den korta armen av kromosom 6, på lokuset 6p12.3, omfattar baserna 49.430.360 till 49.463.328 samt innehåller 13 exon.[4]
MMAA ligger på den långa armen av kromosom 4, på lokuset 4q31.21, omfattar baserna 145.617.428 till 145.660.870 samt innehåller 7 exon.[5]
MMAB ligger på den långa armen av kromosom 12, på lokuset 12q24.11, omfattar baserna 109.553.737 till 109.573.874 samt innehåller 9 exon.[6]
MMADHC ligger på den långa armen av kromosom 2, på lokuset 2q23.2, omfattar baserna 149.569.634 till 149.587.816 samt innehåller 7 exon.[7]
MCEE ligger på den korta armen av kromosom 2, på lokuset 2p13.3, omfattar baserna 71.109.684 till 71.130.239 samt innehåller 3 exon.[8]
Diagnostik[redigera | redigera wikitext]
PKU-testet tas på alla nyfödda i Sverige sedan mitten på 60-talet. Testet går ut på att man tar ett blodprov och sedan letar efter 24 allvarliga medfödda sjukdomar som ingår i screeningen. Metylmalonsyrauri är en av 6 organiska acidurier det screenas efter. Acidurier är en viktig klass av ärftliga metabola sjukdomar som uppkommer på grund av en defekt i de metaboliska signalvägarna för bland annat kolhydrater, fettsyror och aminosyror.
Det tas ett venöst blodprov på 48 h gamla spädbarn, vanligast på handryggen eller i armvecket, det är även vanligt att provet tas i hälen. Man fyller de ringar som finns på pappret på PKU-remissen med blod, det är viktigt att blodet tränger igenom pappret. Analys görs av provet efter att blodet har torkat.[9]
Det görs en tandemmasspektrometri och DNA-extraktion med analys av torkade blodfläckar.[10] I dagsläget används en expanderad screening av nyfödda med hjälp av denna teknik. Tandemmasspektrometri mäter två olika typer av substanser i blodet, aminosyror och acylkarnitiner. Det mäts vilka och hur mycket det finns av varje substans. Vid olika metaboliska sjukdomar kommer det antingen finnas för mycket eller för lite av specifika substanser i blodet och det är därmed möjligt att se om barnet är sjukt eller inte. Dock ger screeningen inte en direkt diagnos, utan om onormala nivåer upptäcks görs ytterligare tester för att fastställa sjukdom.[11]
Differentialdiagnos[redigera | redigera wikitext]
Kombinerad malon- och metylmalonsyrauri (CMAMMA)[redigera | redigera wikitext]
När det gäller förhöjda nivåer av metylmalonsyra kan metylmalonsyrauri snabbt särskiljas från kombinerad malon- och metylmalonsyrauri (CMAMMA) genom att beräkna förhållandet mellan malonsyra och metylmalonsyra i blodplasman, medan en beräkning med värden från urinen är olämplig.[12] Kvoten kan sedan också användas för att avgöra om CMAMMA beror på ACSF3-brist (malonsyra < metylmalonsyra) eller brist på malonyl-CoA-dekarboxylas (malonsyra > metylmalonsyra).[12][13][14]
Behandling[redigera | redigera wikitext]
Vissa former av sjukdomen kan behandlas med injektion av koblamin (B12 responsive MMA). Personer med sjukdomen behandlas med en diet bestående av lågt proteinintag och högt kaloriintag för att minska intaget av proteiner innehållande aminosyrorna threonin, metionin, isoleucin och valin då dessa aminosyror annars kan omvandlas till metylmalonsyra.[3]
Tillskott av L-carnitin tas i vissa fall, vilket är en naturlig substans som hjälper kroppen att bli av med farliga substanser.[15]
mRNA-terapi[redigera | redigera wikitext]
Prekliniska proof-of-concept-studier i djurmodeller har visat att mRNA-terapi även är lämplig för sällsynta metaboliska sjukdomar, inklusive isolerad metylmalonsyrauri.[16][17] I detta sammanhang är det värt att nämna metylmalonsyrauri-terapikandidaten mRNA-3705 från bioteknikföretaget Moderna, som för närvarande befinner sig i fas 1/2.[18]
B12-brist[redigera | redigera wikitext]
Svår B12-brist kan också leda till metylmalonsyrauri. [19] Metylmalonyl-CoA kräver vitamin B12 för att bilda succinyl-CoA. När mängden B12 är otillräcklig för omvandlingen av kofaktor metylmalonyl-CoA till succinyl-CoA, leder uppbyggnaden av oanvänd metylmalonyl-CoA så småningom till en hög koncentration metylmalonsyra i blodet, och som följd metylmalonsyrauri.
Mutationer som försämrar bearbetningen av vitamin B12 leder till en metylmalonsyrauri som kan behandlas med tillskott av vitamin B12.[20] Ett sådant tillstånd är Imerslund–Gräsbecks syndrom.
Lustgas försämrar bearbetningen av vitamin B12.[21] Missbruk av lustgas kan därför leda till neurologiska skador med en ökad halt metylmalonsyra i blodet. [22]
Se även[redigera | redigera wikitext]
Referenser[redigera | redigera wikitext]
Noter[redigera | redigera wikitext]
- ^ Socialstyrelsen, Metylmalonsyrauri
- ^ [a b c] Reference, Genetics Home. ”methylmalonic acidemia” (på engelska). Genetics Home Reference. https://ghr.nlm.nih.gov/condition/methylmalonic-acidemia. Läst 20 februari 2017.
- ^ [a b] ”MMA Study: General Information” (på amerikansk engelska). National Human Genome Research Institute (NHGRI). https://www.genome.gov/19016900/mma-study-general-information/. Läst 20 februari 2017.
- ^ ”Chromosome 6: 49,430,360-49,463,191 - Region in detail - Homo sapiens - Ensembl genome browser 87” (på brittisk engelska). www.ensembl.org. http://www.ensembl.org/Homo_sapiens/Location/View?db=core;g=ENSG00000146085;r=6:49430360-49463191;t=ENST00000274813. Läst 20 februari 2017.
- ^ ”Chromosome 4: 145,617,428-145,660,870 - Region in detail - Homo sapiens - Ensembl genome browser 87” (på brittisk engelska). www.ensembl.org. http://www.ensembl.org/Homo_sapiens/Location/View?db=core;g=ENSG00000151611;r=4:145617428-145660870. Läst 20 februari 2017.
- ^ ”Chromosome 12: 109,553,737-109,573,874 - Region in detail - Homo sapiens - Ensembl genome browser 87” (på brittisk engelska). www.ensembl.org. http://www.ensembl.org/Homo_sapiens/Location/View?db=core;g=ENSG00000139428;r=12:109553737-109573874. Läst 20 februari 2017.
- ^ ”Chromosome 2: 149,569,634-149,587,816 - Region in detail - Homo sapiens - Ensembl genome browser 87” (på brittisk engelska). www.ensembl.org. http://www.ensembl.org/Homo_sapiens/Location/View?db=core;g=ENSG00000168288;r=2:149569634-149587816. Läst 20 februari 2017.
- ^ ”Chromosome 2: 71,109,684-71,130,239 - Region in detail - Homo sapiens - Ensembl genome browser 87” (på brittisk engelska). www.ensembl.org. http://www.ensembl.org/Homo_sapiens/Location/View?db=core;g=ENSG00000124370;r=2:71109684-71130239. Läst 20 februari 2017.
- ^ ”PKU-prov”. Arkiverad från originalet den 14 februari 2017. https://web.archive.org/web/20170214101222/http://www.karolinska.se/globalassets/global/kul/cmms/frldrabroschyr_utfall_201603_inbaddade.pdf. Läst 20 februari 2017.
- ^ Wilcken, Bridget; Wiley, Veronica. ”Newborn screening”. Pathology 40 (2): sid. 104–115. doi:. ISSN 0031-3025. https://www.ncbi.nlm.nih.gov/pubmed/18203033. Läst 20 februari 2017.
- ^ ”NEWBORN SCREENING”. www.newbornscreening.info. Arkiverad från originalet den 18 februari 2017. https://web.archive.org/web/20170218191739/http://www.newbornscreening.info/Parents/info.html. Läst 20 februari 2017.
- ^ [a b] de Sain-van der Velden, Monique G. M. (2016). Eva Morava, Matthias Baumgartner, Marc Patterson, Shamima Rahman, Johannes Zschocke, Verena Peters. red. A New Approach for Fast Metabolic Diagnostics in CMAMMA. "30". Springer Berlin Heidelberg. sid. 15–22. doi:. ISBN 978-3-662-53680-3. http://link.springer.com/10.1007/8904_2016_531
- ^ Alfares, A.; Nunez, L. D.; Al-Thihli, K.; Mitchell, J.; Melancon, S.; Anastasio, N. (2011-09-01). ”Combined malonic and methylmalonic aciduria: exome sequencing reveals mutations in the ACSF3 gene in patients with a non-classic phenotype” (på engelska). Journal of Medical Genetics 48 (9): sid. 602–605. doi:. ISSN 0022-2593. https://jmg.bmj.com/lookup/doi/10.1136/jmedgenet-2011-100230.
- ^ Dewit, M; Decoo, I; Verbeek, E; Schot, R; Schoonderwoerd, G; Duran, M (2006-02). ”Brain abnormalities in a case of malonyl-CoA decarboxylase deficiency” (på engelska). Molecular Genetics and Metabolism 87 (2): sid. 102–106. doi:. https://linkinghub.elsevier.com/retrieve/pii/S1096719205003033.
- ^ Penn, D.; Schmidt, H.; Otten, A.; Schmidt-Sommerfeld, E.. ”[Carnitine in the treatment of methylmalonic aciduria (MMA)”]. Monatsschrift Kinderheilkunde: Organ Der Deutschen Gesellschaft Fur Kinderheilkunde 134 (10): sid. 758–761. ISSN 0026-9298. https://www.ncbi.nlm.nih.gov/pubmed/2879226. Läst 20 februari 2017.
- ^ An, Ding; Schneller, Jessica L.; Frassetto, Andrea; Liang, Shi; Zhu, Xuling; Park, Ji-Sun (2017-12). ”Systemic Messenger RNA Therapy as a Treatment for Methylmalonic Acidemia” (på engelska). Cell Reports 21 (12): sid. 3548–3558. doi:. PMID 29262333. PMC: 9667413. https://linkinghub.elsevier.com/retrieve/pii/S2211124717317485.
- ^ Martini, Paolo G.V.; Guey, Lin T. (2019-10-01). ”A New Era for Rare Genetic Diseases: Messenger RNA Therapy” (på engelska). Human Gene Therapy 30 (10): sid. 1180–1189. doi:. ISSN 1043-0342. https://www.liebertpub.com/doi/10.1089/hum.2019.090.
- ^ ”A Clinical Trial of a Methylmalonic Acidemia (MMA) Due to MUT Deficiency Treatment for Children and Adults”. https://trials.modernatx.com/study/?id=mRNA-3705-P101. Läst 4 januari 2024.
- ^ Higginbottom, Marilyn C.; Sweetman, Lawrence; Nyhan, William L. (1978-08-17). ”A Syndrome of Methylmalonic Aciduria, Homocystinuria, Megaloblastic Anemia and Neurologic Abnormalities in a Vitamin B12-Deficient Breast-Fed Infant of a Strict Vegetarian”. New England Journal of Medicine (Massachusetts Medical Society) 299 (7): sid. 317–323. doi:. ISSN 0028-4793.
- ^ ”Orphanet: Vitamin B12 responsive methylmalonic acidemia”. Orphanet. 2022-07-16. https://www.orpha.net/consor/cgi-bin/OC_Exp.php?Expert=28.
- ^ Kalikiri, Pramood C.; Sachan, Reena Sachan Gajraj Singh (2003-12-31). ”Nitrous Oxide Induced Elevation Of Plasma Homocysteine And Methylmalonic Acid Levels And Their Clinical Implications”. The Internet Journal of Anesthesiology 8 (2). https://ispub.com/IJA/8/2/12867. Läst 17 juli 2022.
- ^ Duque, Miriam Andrea; Kresak, Jesse L.; Falchook, Adam; Harris, Neil S. (2015-11-01). ”Nitrous Oxide Abuse and Vitamin B12Action in a 20-Year-Old Woman: A Case Report”. Laboratory Medicine (Oxford University Press (OUP)) 46 (4): sid. 312–315. doi:. ISSN 0007-5027.
