Tetranitrometan
| Tetranitrometan | |
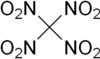  | |
| Systematiskt namn | tetranitrometan |
|---|---|
| Övriga namn | TNM, Tetan |
| Kemisk formel | CN4O8 |
| Molmassa | 196,04 g/mol |
| Utseende | Färglös till blekgul vätska eller fast |
| CAS-nummer | 509-14-8 |
| Egenskaper | |
| Densitet | 1,623 g/cm³ |
| Löslighet (vatten) | Olöslig |
| Smältpunkt | 13,8 °C |
| Kokpunkt | 126 °C |
| Faror | |
| Huvudfara | Oxidant, kan bilda explosiva blandningar. |
| NFPA 704 | |
| SI-enheter & STP används om ej annat angivits | |
Tetranitrometan eller TNM är ett organiskt oxidationsmedel med kemiska formeln CN4O8. Dess kemiska struktur består av fyra nitrogrupper bundna till en kolatom. Ämnet syntetiserades första gången 1857 genom reaktion av natrium-cyanoacetamid med salpetersyra.
Egenskaper[redigera | redigera wikitext]
Tetranitrometan är en vattenolöslig, blekgul och giftig vätska med kokpunkt 126 °C. Blandningar med kolväten, t. ex. toluen, är högexplosiva.
Framställning[redigera | redigera wikitext]
TNM kan framställas i laboratoriskala genom nitrering av ättiksyraanhydrid med vattenfri salpetersyra (Chattawaymetoden).
Den första produktion i industriell skala påbörjades i Tyskland under andra världskriget i ett försök att förbättra cetantalet hos dieselbränsle. Denna process hade förbättrat den ursprungliga metoden, som inleddes med ättiksyra och salpetersyra. Utan hänsyn till utbyte eller kostnad, producerades cirka 10 ton TNM under några veckor, men produktionen upphörde av ekonomiska skäl efter krigsslutet.
För kommersiell användning har använts en billigare metod utgående från acetylen där salpetersyra innehållande kvicksilvernitrat reduceras med acetylen, vilket resulterar i nitroform (trinitrometan) och en blandning av koldioxid och kväveoxid som biprodukter. Kväveoxiderna är värdefulla och utvinnes normalt som salpetersyra i ett absorptionstorn. Resulterande nitroform omvandlas till TNM genom tillsats av salpetersyra och svavelsyra vid högre temperaturer. Med denna metod kan nås ett utbyte av 90% (baserat på salpetersyra) före rening.
Användning[redigera | redigera wikitext]
TNM har provats som ett oxidationsmedel i bipropellanta raketer men dess höga smältpunkt gör den olämplig för detta. Högrenat tetranitrometan kan inte göras explosivt, men dess känslighet ökas dramatiskt genom föroreningar av oxider, som t. ex. antifrysmedel. Detta gör det oanvändbart som drivmedel.
I laboratorier används TNM som en reagens för detektering av dubbelbindningar i organiska föreningar och som en nitrerande reagens. Det har också funnit användning som tillsats till dieselbränsle för att öka cetantalet.
Säkerhet[redigera | redigera wikitext]
Förmågan hos TNM att detonera påverkas i hög grad av närvaron av föroreningar, även i små mängder. TNM formar extremt kraftfulla explosiva blandningar när bränslen tillsätts i stökiometriska proportioner. Många av dessa blandningar visar känslighet för inverkan som är ännu högre än den för nitroglycerin.
TNM reagerar med fukt vid förhöjt pH-värde till att producera trinitrometan (nitro) som reagerar lätt med metaller och kan bilda mycket instabila och explosiva salter.
TNM är mycket giftigt. Absorption av så lite som 2,5 mg/kg kan orsaka metemoglobinemi, lungödem, och skador på lever, njurar och centrala nervsystemet. Det är sannolikt också cancerframkallande för människor.
Källor[redigera | redigera wikitext]
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, tidigare version.
- Bra Böckers lexikon, 1977

