Kymotrypsin
Kymotrypsin är ett enzym som spjälkar proteiner i människans matspjälkningskanal. Kymotrypsin bildas ur inaktivt kymotrypsinogen och är en komponent av digimotrypsin. Det verkar främst i tolvfingertarmen där den utför proteolys, nedbrytning av proteiner och polypeptider[1]genom att katalysera spjälkningen av peptidbindningar där sidokedjan av aminosyran N-terminal till den sprickbara amidbindningen (P1-positionen) är en stor hydrofob aminosyra (tyrosin, tryptofan och fenylalanin).[2] Dessa aminosyror innehåller en aromatisk ring i dess sidokedja som passar in i en hydrofob ficka (S1-positionen) av enzymet. Det aktiveras i närvaro av trypsin. Den hydrofoba och formkomplementariteten mellan peptidsubstratet P1-sidokedjan och enzymet S1-bindande kaviteten svarar för substratspecificationen av detta enzym.[3][4] Kymotrypsin hydrolyserar också andra amidbindningar i peptider med långsammare hastigheter, särskilt de som innehåller leucin i P1-positionen.[2]
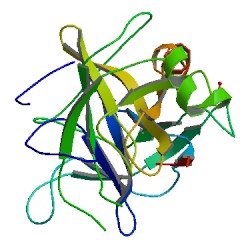
Strukturellt är det den arketypiska strukturen för dess superfamilj, PA-klanen av proteaser.
Aktivering[redigera | redigera wikitext]
Kymotrypsin syntetiseras i bukspottkörteln. Dess grundmaterial är kymotrypsinogen. Trypsin aktiverar kymotrypsinogen genom att klyva peptidbindningar i positionerna Arg15 – Ile16 och producerar π-kymotrypsin. I sin tur interagerar amingrupp (-NH3+ ) hos Ile16-resten med sidokedjan av Asp194, vilket producerar "oxianjonhålet" och den hydrofoba "S1-fickan". Dessutom inducerar kymotrypsin dess egna aktivering genom att klyva i positionerna 14–15, 146–147 och 148–149, vilket producerar α-kymotrypsin (som är mer aktivt och stabilt än π-kymotrypsin).[6] Den resulterande molekylen är en tre-polypeptidmolekyl som är sammankopplad via disulfidbindningar.
Verkningsmekanism och kinetik[redigera | redigera wikitext]

In vivo är kymotrypsin ett proteolytiskt enzym (serinproteas) som verkar i matsmältningssystemet hos många organismer. Det underlättar klyvningen av peptidbindningar genom en hydrolysreaktion, som trots att den är termodynamiskt gynnsam, sker extremt långsamt i frånvaro av en katalysator. Huvudsubstraten för kymotrypsin är peptidbindningar där aminosyran N-terminal till bindningen är tryptofan, tyrosin, fenylalanin eller leucin. Liksom många proteaser, hydrolyserar kymotrypsin också amidbindningar in vitro, en fördel som möjliggjorde användningen av substratanaloger såsom N-acetyl-L-fenylalanin-p-nitrofenylamid för enzymanalyser.
Kymotrypsin klyver peptidbindningar genom att attackera den oreaktiva karbonylgruppen med en kraftfull nukleofil, serin 195-resten som ligger i enzymets aktiva ställe, som kort blir kovalent bunden till substratet och bildar en enzym-substrat-mellanprodukt. Tillsammans med histidin 57 och asparaginsyra 102 utgör denna serinrest den katalytiska triaden av det aktiva stället. Dessa fynd grundar sig på inhiberingsanalyser och studien av kinetiken för klyvning av det tidigare nämnda substratet, med utnyttjande av det faktum att enzym-substrat-intermediären p-nitrofenolat har gul färg, vilket möjliggör mätning av dess koncentration genom att mäta ljusabsorbans vid 410 nm.
Kymotrypsinkatalys av hydrolysen av ett proteinsubstrat (i rött) utförs i två steg. För det första förstärks nukleofilicitet hos Ser-195 genom generell baskatalys där protonen i serinhydroxylgruppen överförs till imidazoldelen av His-57 under dess attack på det elektronfattiga karbonylkolet i proteinsubstratets huvudkedja (k1 steg). Detta sker via den samordnade verkan av tre-aminosyraresterna i den katalytiska triaden. Uppbyggnaden av negativ laddning på den resulterande tetraedriska intermediären stabiliseras i enzymets aktiva ställes oxyanjonhål genom bildning av två vätebindningar till intilliggande amidväte i huvudkedjan.
His-57-imidazoliumdelen som bildas i k1-steget är en allmän syrakatalysator för k-1-reaktionen. Emellertid har bevis för liknande generell sur katalys av k2-reaktionen (Tet2)[7] varit kontroversiella.[8]Uppenbarligen ger vatten en proton till den lämnande amingruppen.
Nedbrytning av Tet1 (via k3) genererar ett acylenzym, som hydrolyseras med His-57 som fungerar som en allmän bas (kH2O) under bildning av en tetraedrisk mellanprodukt, som bryts ner för att regenerera serinhydroxyldelen, såväl som proteinfragmentet med den nybildade karboxylterminalen.
Se även[redigera | redigera wikitext]
Referenser[redigera | redigera wikitext]
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Chymotrypsin, 18 mars 2023.
Noter[redigera | redigera wikitext]
- ^ Wilcox PE (1970). ”[5] Chymotrypsinogens—chymotrypsins”. Chymotrypsinogens — chymotrypsins. Methods in Enzymology. "19". Sid. 64–108. doi:. ISBN 978-0-12-181881-4.
- ^ [a b] Cotten, Steven W. (2020-01-01), Clarke, William; Marzinke, Mark A., red., ”Chapter 33 - Evaluation of exocrine pancreatic function” (på engelska), Contemporary Practice in Clinical Chemistry (Fourth Edition) (Academic Press): s. 573–585, ISBN 978-0-12-815499-1, https://www.sciencedirect.com/science/article/pii/B9780128154991000338, läst 18 mars 2023
- ^ Appel W (December 1986). ”Chymotrypsin: molecular and catalytic properties”. Clin. Biochem. 19 (6): sid. 317–22. doi:. PMID 3555886.
- ^ ”Mapping the active site of papain with the aid of peptide substrates and inhibitors”. Philos. Trans. R. Soc. Lond. B Biol. Sci. 257 (813): sid. 249–64. February 1970. doi:. PMID 4399049. Bibcode: 1970RSPTB.257..249B.
- ^ ”Chymotrypsinogen: 2.5-angstrom crystal structure, comparison with alpha-chymotrypsin, and implications for zymogen activation”. Biochemistry 9 (9): sid. 1997–2009. April 1970. doi:. PMID 5442169.
- ^ Phillips, Jo (2019). Fundamentals of Enzymology. EDTECH. Sid. 117. ISBN 9781839471605.
- ^ Fersht, A.R.; Requena, Y. (1971). ”Mechanism of the -Chymotrypsin-Catalyzed Hydrolysis of Amides. pH Dependence of kc and Km.”. J. Am. Chem. Soc. 93 (25): sid. 7079–87. doi:. PMID 5133099.
- ^ Zeeberg, B.; Caswell, M.; Caplow, M. (1973). ”Concerning a reported change in rate-determining step in chymotrypsin catalysis”. J. Am. Chem. Soc. 95 (8): sid. 2734–5. doi:. PMID 4694533.
Vidare läsning[redigera | redigera wikitext]
- Biochemistry. San Francisco: W.H. Freeman. 2002. ISBN 0-7167-4684-0.
- Biochemistry. Australia: Thomson Brooks/Cole. 2005. ISBN 0-534-49033-6.
Externa länkar[redigera | redigera wikitext]
 Wikimedia Commons har media som rör Kymotrypsin.
Wikimedia Commons har media som rör Kymotrypsin.- The MEROPS online database for peptidases and their inhibitors: S01.001
|
