Kreatin
| Kreatin | |
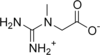  | |
| Systematiskt namn | 2-(Metylguanidino)ättiksyra |
|---|---|
| Kemisk formel | C4H9N3O2 |
| Molmassa | 131,13 g/mol |
| Utseende | Vit, fast |
| CAS-nummer | 57-00-1 |
| SMILES | NC(=N)N(C)CC(=O)O |
| Egenskaper | |
| Densitet | 1,33 g/cm³ |
| Löslighet (vatten) | 17 g/l |
| Smältpunkt | 303 °C (sönderfaller) |
| Faror | |
| Huvudfara | |
| SI-enheter & STP används om ej annat angivits | |
Kreatin är ett ämne som hjälper till att omvandla lagrad energi till rörelseenergi. Ämnet förekommer naturligt i kroppen och går att hitta i livsmedel så som kött och fisk. Kreatin kan även konsumeras som kosttillskott
Med normal kosthållning bildar människokroppen cirka 1-2 gram kreatin per dag, men då ämnet kan också tas som kosttillskott kan halterna bli avsevärt högre.[1]
Biosyntes[redigera | redigera wikitext]
Kreatin är en kvävehaltig organisk syra bestående av den kemiska kombination av tre aminosyror, arginin, glycin och metionin. Syntesen sker i två steg med hjälp av enzymerna amidinotransferas, metyltransferas. Det kan sedan reagerara vidare i olika tredje steg, där det genom fosforylering via ATP bildar kreatinfosfat (CrP).
I det första steget reagerar arginin och glycin under amidinotransferas till att bilda ornitin och guanidinoacetat. Ornitinet avgår medan guanidinoacetat fortsätter processen.
I det andra steget metyleras guanidinoacetat av enzymet metyltransferas, som tillsammans med kosubstratet S-Adenosylmetionin för över metylgruppen från metionin. Detta ger kreatin och en s-adenosylhomocysteinmolekyl.[2]
I det tredje steget fosforyleras kreatin av någon form av isoenzymerna kreatinkinas. Vilken form av kreatinkinas beror på i vilken vävnad processen sker. Detta steg är reversibelt och kreatinfosfat uppnår en jämvikt med kreatin.[3]

Funktion i kroppen[redigera | redigera wikitext]
Kreatin finns i höga halter i vävnader med hög och oregelbunden energiförbrukning, främst hjärt- och skelettmuskulatur samt grå hjärnsubstans. Det är där de omvandlas till kreatinfosfat som sedan agerar extraenergi vid hög belastning. Detta genom att avge den fosfatgrupp som fästs och gjort återbilda ATP på plats i cellen, en process som går mycket snabbare än nyproduktion av ATP via oxidativ fosforylering. Detta gör att kreatinfosfat kan agera nödreserv för energiförbrukande celler, som kan prestera på maxnivå en kort stund extra, trots att det redan existerande lagret av ATP är slut och ingen ny ATP hunnit bildas.[4]
Användningsområden[redigera | redigera wikitext]
Kosttillskott
När kreatin intas som kosttillskott i samband med styrketräning har det i studier visat sig öka både muskeltillväxten och styrkeutvecklingen hos försökspersonerna jämfört med de som fått placebo.[5][6] Som kosttillskott säljs det främst i den kemiska formen kreatinmonohydrat - ett vitt, kristallint pulver med måttlig vattenlöslighet. Ämnet omvandlas i kroppen till den aktiva formen kreatinfosfat och utövar sin effekt främst i musklerna, genom att donera fosfatgruppen till ADP-molekylen, så att nytt ATP kan bildas. ATP är den universella energidonatorn, som används för att driva annars omöjliga reaktioner i alla kända nu levande organismer.
Eftersom kreatin inte förändrar det hormonella systemet eller andra fysiologiska system (t.ex. blodet) är det inte dopingklassat.
Diagnostiskt verktyg
Det kreatinkinas som finns i hjärtat frigörs i blodet vid skada på hjärtmuskelceller. Det frisätts i blodet cirka två timmar efter skadan och når toppnivå mellan tolv och trettiosex timmar. Det kan därför användas som diagnosverktyg för att avgöra när en infarkt skett. Vidare kan det kreatinin som bildas när kreatin bryts ner i kroppen och sedan utsöndras via urinen användas för att mäta njurfunktion.
Källor[redigera | redigera wikitext]
- ^ Abrahamsson, Lillemor; Andersson, Agneta; Becker, Wulf; Nilsson, Gerd, red (2006). Näringslära för högskolan. LIBER. ISBN 91-47-05355-0
- ^ Nelson, David L.; Cox, Michael M. (2013). Principles of Biochemistry. sid. 907. ISBN 1-4641-0962-1. Läst 14 april 2013
- ^ Nelson; Cox. sid. 946
- ^ Nelson; Cox. sid. 946-947
- ^ Rawson, Eric S.; Volek, Jeff S.. ”Effects of creatine supplementation and resistance training on muscle strength and weightlifting performance”. Journal of Strength and Conditioning Research / National Strength & Conditioning Association 17 (4): sid. 822–831. ISSN 1064-8011. http://www.ncbi.nlm.nih.gov/pubmed/14636102. Läst 17 februari 2016.
- ^ Nissen, Steven L.; Sharp, Rick L.. ”Effect of dietary supplements on lean mass and strength gains with resistance exercise: a meta-analysis”. Journal of Applied Physiology (Bethesda, Md.: 1985) 94 (2): sid. 651–659. doi:. ISSN 8750-7587. http://www.ncbi.nlm.nih.gov/pubmed/12433852. Läst 17 februari 2016.
