TFIIH
TFIIH är en basal transkriptionsfaktor vars roll är att bidra med helikas- och kinasaktivitet. TFIIH består av flera underenheter. Helikasaktiviteten särar på DNAsträngarna så att en transkriptionsbubbla bildas, detta görs av subenheterna XPB och XPD. Kinaset, som består av ett komplex av Cdk7/cyklin H, hyperfosforylerar den C-terminala domänen av RNA-polymeras II vilket startar transkriptionen. TFIIH kom först i dagen 1989 när generell transkriptionsfaktor-δ eller grundläggande transkriptionsfaktor 2 karakteriserades som en oumbärlig transkriptionsfaktor in vitro. Denna faktor isolerades 1992 också från jäst och gavs slutligen namnet TFIIH.[1][2]
TFIIH består av tio underenheter, varav 7 (ERCC2/XPD, ERCC3 /XPB, GTF2H1/p62, GTF2H4/p52, GTF2H2/p44, GTF2H3/p34 ochGTF2H5/TTDA) utgör kärnkomplexet. Det cyklinaktiverande kinasunderkomplexet (CDK7, MAT1 och cyklin H) är kopplat till kärnan via XPD-proteinet.[3] Två av underenheterna, ERCC2/XPD och ERCC3/XPB, har helikas- och ATPas-aktiviteter och hjälper till att skapa transkriptionsbubblan. I ett provrör krävs dessa underenheter endast för transkription om DNA-mallen inte redan är denaturerad eller om den är superlindad.
Två andra TFIIH-underenheter, CDK7 och cyklin H, fosforylat serinaminosyror på RNA-polymeras II C-terminaldomänen och möjligen andra proteiner medverkar i cellcykeln. Förutom en vital funktion vid transkriptionsinitiering är TFIIH också involverad i nukleotidexcisionsreparation.
Struktur hos TFIIH[redigera | redigera wikitext]
TFIIH är ett tiounderenhetskomplex. Sju av dessa underenheter utgör "kärnan" medan tre innefattar den dissocierbara "CAK"-modulen (CDK Activating Kinase).[4] Kärnan består av underenheter XPB, XPD, p62, p52, s. 44, p34 och p8 medan CAK är sammansatt av CDK7, cyklin H och MAT1.[5]
Funktioner[redigera | redigera wikitext]
Allmän funktion för TFIIH är
(NER) TFIIH är en allmän transkriptionsfaktor som verkar för att rekrytera RNA Pol II till promotorerna av gener. Den fungerar som en helikas som lindar upp DNA. Den lindar också upp DNA efter att en DNA-skada har identifierats av antingen den globala genomreparationsvägen (GGR) eller den transkriptionskopplade reparationsvägen (TCR) av NER.[7][8] Renad TFIIH har en roll i att stoppa ytterligare RNA-syntes genom att aktivera den cykliska peptiden α-amanitin.
Trikotiodystrofi[redigera | redigera wikitext]
Mutation i generna ERCC3 (XPB), ERCC2 (XPD) eller GTF2H5 (TTDA) orsakar trikotiodystrofi, ett tillstånd som kännetecknas av ljuskänslighet, iktyos, skört hår och naglar, intellektuell funktionsnedsättning, minskad fertilitet och/eller kortväxthet.[9]
Sjukdom[redigera | redigera wikitext]
Genetiska polymorfismer av gener som kodar för subenheter av TFIIH är kända för att vara förenade med ökad cancerkänslighet i många vävnader, till exempel hudvävnad, bröstvävnad och lungvävnad. Mutationer i underenheterna (som XPD och XPB) kan leda till en mängd olika sjukdomar, såsom xeroderma pigmentosum (XP) eller XP kombinerat med Cockayne syndrom.[10] Förutom genetiska variationer riktar sig viruskodade proteiner även mot TFIIH.[11]
DNA-reparation[redigera | redigera wikitext]
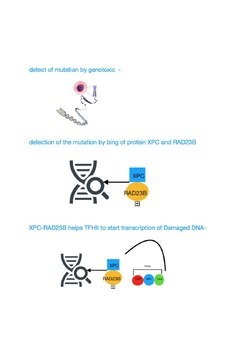
TFIIH deltar i nukleotidexcisionsreparation (NER) genom att öppna DNA-dubbelhelixen efter att skadan initialt har upptäckts. NER är en flerstegsväg som tar bort en lång rad olika skador som förvränger normal basparning, inklusive skrymmande kemiska skador och UV-orsakade skador. Individer med mutationsdefekter i gener som specificerar proteinkomponenter som katalyserar NER-vägen, inklusive TFIIH-komponenterna, visar ofta drag av för tidigt åldrande.[9][12]
Inhibitorer[redigera | redigera wikitext]
Potenta, bioaktiva naturliga produkter som triptolid som hämmar transkription hos däggdjur via hämning av XPB-subenheten av den allmänna transkriptionsfaktorn TFIIH har nyligen (2020) rapporterats som ett glukoskonjugat för att rikta in sig på hypoxiska cancerceller med ökat glukostransportöruttryck.[13]
Referenser[redigera | redigera wikitext]
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Transcription factor II H, 23 februari 2023.
Noter[redigera | redigera wikitext]
- ^ ”Factors involved in specific transcription by mammalian RNA polymerase II. Identification and characterization of factor IIH”. The Journal of Biological Chemistry 267 (4): sid. 2786–93. February 1992. doi:. PMID 1733973.
- ^ ”Mechanism of ATP-dependent promoter melting by transcription factor IIH”. Science 288 (5470): sid. 1418–22. May 2000. doi:. PMID 10827951. Bibcode: 2000Sci...288.1418K.
- ^ ”Transcription of eukaryotic protein-coding genes”. Annual Review of Genetics 34: sid. 77–137. 2000. doi:. PMID 11092823.
- ^ ”Dual role of TFIIH in DNA excision repair and in transcription by RNA polymerase II”. Nature 368 (6473): sid. 769–72. April 1994. doi:. PMID 8152490. Bibcode: 1994Natur.368..769D.
- ^ ”Dual role of TFIIH in DNA excision repair and in transcription by RNA polymerase II”. Nature 368 (6473): sid. 769–72. April 1994. doi:. PMID 8152490. Bibcode: 1994Natur.368..769D.
- ^ [a b] ”TFIIH: when transcription met DNA repair”. Nature Reviews. Molecular Cell Biology 13 (6): sid. 343–54. May 2012. doi:. PMID 22572993.
- ^ ”Rapid switching of TFIIH between RNA polymerase I and II transcription and DNA repair in vivo”. Molecular Cell 10 (5): sid. 1163–74. November 2002. doi:. PMID 12453423.
- ^ ”TFIIH is an elongation factor of RNA polymerase I”. Nucleic Acids Research 40 (2): sid. 650–9. January 2012. doi:. PMID 21965540.
- ^ [a b] ”TTDA: big impact of a small protein”. Experimental Cell Research 329 (1): sid. 61–8. November 2014. doi:. PMID 25016283.
- ^ ”Phenotypic heterogeneity in the XPB DNA helicase gene (ERCC3): xeroderma pigmentosum without and with Cockayne syndrome”. Human Mutation 27 (11): sid. 1092–103. November 2006. doi:. PMID 16947863.
- ^ ”TFIIH transcription factor, a target for the Rift Valley hemorrhagic fever virus”. Cell 116 (4): sid. 541–50. February 2004. doi:. PMID 14980221.
- ^ ”Genome Instability in Development and Aging: Insights from Nucleotide Excision Repair in Humans, Mice, and Worms”. Biomolecules 5 (3): sid. 1855–69. August 2015. doi:. PMID 26287260.
- ^ ”A Glucose-Triptolide Conjugate Selectively Targets Cancer Cells under Hypoxia”. iScience 23 (9): sid. 101536. 2020. doi:. PMID 33083765. Bibcode: 2020iSci...23j1536D.
Externa länkar[redigera | redigera wikitext]
