Acetonperoxid
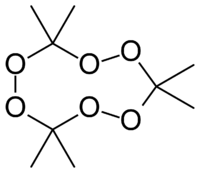
Acetonperoxid, triacetontriperoxid (TATP), tricykloacetonperoxid (TCAP) eller acetontricykloperoxid (ATCP) är en organisk peroxid och ett kraftigt sprängämne.[1] Richard Wolffenstein upptäckte av misstag ämnet år 1895 när han skulle peroxidera alkaloiden koniin, löst i aceton.[2] Acetonperoxid kan syntetiseras med saltsyra, väteperoxid och aceton, kemikalier som finns i en vanlig färghandel, vilket har gjort att det är populärt bland spänningssökande ungdomar. Detta leder regelbundet till både skadegörelse och svåra olyckor där bombmakarna själva drabbas.
Värme, en liten stöt eller friktion kan räcka för att utlösa en explosion. Så lite som ett par gram kan spränga bort delar av en hand. Internationellt sett är det många som tillverkar explosiva ämnen hemma som själva skadas, både vid pojkstreck som går snett och allvarlig brottslighet.[3]
Terrorister har i allmänhet valt att avstå från att använda TATP, eftersom det är förhållandevis känsligt och oberäkneligt. Speciellt vid brister i tillverkningen kan ämnet bli mycket känsligt för värme och stötar, känsligare än nitroglycerin. Ett undantag var dock Terrordåden i Bryssel 2016. Ett annat var den så kallade skobombaren Richard Reid, som hade fyllt klacken på sin sko med TATP i ett försök att spränga ett flygplan. I just det fallet var TATP oberäkneligt åt det tursamma hållet, då Reid inte lyckades bringa bomben att explodera. Man har även haft misstankar om att man skulle använt sig av TATP i en terroristattack som brittisk polis lyckades förhindra. Detta är dock endast misstankar om vad man skulle kunna använda sig av.
Riskfraser 3 Mycket explosivt vid stöt, friktion, eld eller annan antändningsorsak. CAS-nummer 17088-37-8 Bruttoformel: C9H18O6 Molmassa: 222,24 g/mol Kokpunkt: 165 °C Smältpunkt: 97 °C Densitet: 1220 kg/m³ Detonationshastighet: 5400 m/s Ämnet är instabilt och sönderfaller efter en tid. Källa:Prevent Kemiska Ämnen[4]
Kemin[redigera | redigera wikitext]
Acetonperoxid erhålls genom en reaktion mellan väteperoxid och aceton med hjälp av en syra som katalysator vilket vanligtvis är HCl
H2O2 + 2 H+ + 2 Cl- → Cl2 + 2 H2O
H2O2 + Cl2 → O2 + 2 H+ + 2 Cl-
3 H2O2 + 3 CH3COCH3 → C9H18O6 + 3 H2O
Mindre mängder än ca 4 gram brinner generellt när det antänds, mer än 4 gram brukar detonera när det antänds.
Helt torr acetonperoxid bringas till detonation mycket lättare än den "färska" produkten som är blöt/fuktig av vatten och/eller aceton.
Oxidationen som sker vid förbränning är:
2 C9H18O6 + 21 O2 → 18 H2O + 18 CO2
Referenser[redigera | redigera wikitext]
- ^ ChemSub Online: Triacetone triperoxide
- ^ Wolffenstein, R (1895). ”Über die Einwirkung von Wasserstoffsuperoxyd auf Aceton und Mesityloxyd (On the effect of hydrogen peroxide on acetone and mesityl oxide)”. Berichte der Deutschen chemischen Gesellschaft 28 (2): sid. 2265-2269. doi:. http://gallica.bnf.fr/ark:/12148/bpt6k90739s/f995.image.langEN.
- ^ ”Explosioner ökar - Trend bland kriminella att använda handgranater”. Artikeln publicerades i tidningen Kriminalteknik, nummer 1 år 2018.. Nationellt forensiskt centrum. https://nfc.polisen.se/link/00a2823ae03e4497a444d274300faef1.
- ^ ”Arkiverade kopian”. Arkiverad från originalet den 25 maj 2012. https://archive.is/20120525110935/http://www.prevent.se/sv/arbetsliv/artikel/2006/kunskap-om-30-000-kemiska-amnen/. Läst 25 maj 2012.
