Cyaniner
Cyaniner även kallade tetrametylindo(di)-karbocyaniner,[1] är en grupp av syntetiska färgämnen som hör till gruppen polymetiner. Beroende på strukturen täcker de ett spektrum från infrarött till ultraviolett.
Kemiskt är cyaniner ett konjugerat system mellan två kväveatomer; I varje resonansstruktur oxideras exakt en kväveatom till ett iminium. Vanligtvis utgör de en del av ett kvävehaltigt heterocykliskt system.[2]
Cyaniner har många användningsområden som fluorescerande färgämne, speciellt inom biokemin. Huvudapplikationen för cyaninfärger är i biologisk märkning. Ändå finns det en bred litteratur om både deras syntes och användningsområden, och cyaniner är vanliga i vissa CD- och DVD-medier.
Struktur[redigera | redigera wikitext]

I = Streptocyaniner,
II = Hemicyaniner,
III = Slutna cyaniner
Cyaniner har klassificerats på många sätt:[3]
- Streptocyaniner eller öppna cyaniner:
- R2N+=CH[CH=CH]n-NR2 (I)
- Hemicyaniner:
- Aryl=N+=CH[CH=CH]n-NR2 (II)
- Slutna cyaniner:
- Aryl=N+=CH[CH=CH]n-N=Aryl (III)
Dessutom känns dessa klasser igen:[4]
- Neutrocyaniner:
- R2N+=CH[CH=CH]n-CN and R2N+=CH[CH=CH]n-CHO
- Merocyaniner including spiropyraner och kinoftaloner.
- Apocyaniner
där två kvartära kväveatomer är anslutna till polymetinkedjan.[5] Båda kvävena kan var och en vara oberoende av en heteroaromatisk del, såsom pyrrol, imidazol, tiazol, pyridin, kinolin, indol, bensotiazol, etc.
Historik och användning inom industrin[redigera | redigera wikitext]
Cyaniner syntetiserades först för över ett sekel sedan. De användes ursprungligen och görs så fortfarande, för att öka känslighetsområdet för fotografiska emulsioner, det vill säga för att öka våglängdsområdet som kommer att bilda en bild på filmen, vilket gör filmen pankromatisk.[4] Cyaniner används också i CD-R- och DVD-R-media. De som används är mestadels gröna eller ljusblå färger och är kemiskt instabila. Av den anledningen är ostabiliserade cyaninskivor olämpliga för arkivering av CD och DVD. Nya cyaninskivor innehåller stabilisatorer,[6] som vanligtvis är en metallatom bunden till cyaninmolekylen som bromsar försämringen avsevärt. Dessa skivor är ofta klassade med en arkivlivslängd på 75 år eller mer. De andra färgämnena som används i CD-R är ftalocyanin och azo.
Användning inom bioteknik[redigera | redigera wikitext]
För tillämpningar inom bioteknik syntetiseras speciella cyaninfärger från 2, 3, 5 eller 7-metinstrukturer med reaktiva grupper på endera eller båda kväveändarna så att de kan kopplas kemiskt till antingen nukleinsyror eller proteinmolekyler. Märkning görs för visualiserings- och kvantifieringsändamål. Biologiska tillämpningar är jämförande genomisk hybridisering och genchips, som används i transkriptomik, och olika studier inom proteomik såsom RNA-lokalisering,[7] molekylära interaktionsstudier genom fluorescensresonansenergiöverföring (FRET) och fluorescerande immunanalyser.
Cyaninfärger finns med olika modifieringar såsom metyl-, etyl- eller butylsubstituenter, karboxyl-, acetylmetoxi- och sulfogrupper som förändrar deras hydrofilicitet.[8]
| Sond | Ex (nm) | Em (nm) | MW | Kvantutbyte |
|---|---|---|---|---|
| Cy2 | 489 | 506 | 714 | QY 0.12 |
| Cy3 | (512);550 | 570;(615) | 767 | QY 0.15 [9]* |
| Cy3B | 558 | 572;(620) | 658 | QY 0.67 |
| Cy3.5 | 581 | 594;(640) | 1102 | QY 0.15 |
| Cy5 | (625);650 | 670 | 792 | QY 0.27[9] |
| Cy5.5 | 675 | 694 | 1128 | QY 0.28[10] |
| Cy7 | 743 | 767 | 818 | QY 0.28 |
Ex (nm): Excitationsvåglängd i nanometer Em (nm): Emissionsvåglängd i nanometer MW: Molekylvikt QY: Kvantutbyte
- Beror starkt på viskositet, temperatur, och biomolekylära interaktioner.[11]
Vanliga cyaninfärgämnen och deras användningsområden[redigera | redigera wikitext]
Eftersom de ger ljusare och stabilare fluorescens kan cyaniner med fördel ersätta konventionella färgämnen som fluorescein och rodaminer.
- Cy3 och Cy5 är de mest populära, som vanligtvis kombineras för 2-färgdetektering.
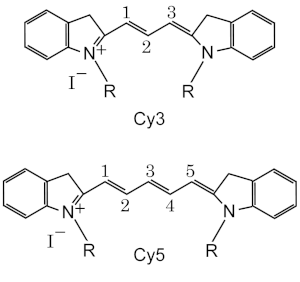
Cy3 fluorescerar gröngul (~ 550 nm excitation, ~ 570 nm emission), medan Cy5 är fluorescerande i det fjärröda området (~ 650 excitation, 670 nm emissikon).[12] Cy3 kan detekteras av olika fluorimetrar, bildläsare och mikroskop med standardfilter för tetrametylrhodamin (TRITC). På grund av sin höga molära skymningskoefficient detekteras detta färgämne också lätt med blotta ögat på elektroforesgeler och i lösning. Cy5 blev en populär ersättning för långt röda fluorescerande färgämnen på grund av dess höga skymningskoefficient (så liten som 1 nanomol kan detekteras i gelelektrofores med blotta ögat) och dess fluoroforemission maximalt i det röda området, där många CCD-detektorer har maximal känslighet och biologiska föremål ger låg bakgrundsinterferens.
Scanrarna använder faktiskt olika laseremissionsvåglängder (vanligtvis 532 nm och 635 nm) och filtervåglängder (550-600 nm och 655-695 nm) för att undvika bakgrundskontaminering. De kan därmed enkelt skilja färger från Cy3 och från Cy5, och kan också kvantifiera mängden Cy3- och Cy5-märkning i ett prov (multiparametrisk detektering).
- Andra användbara cyaninfärgämnen är:
Cy3.5 kan ersätta sulfoRhodamine 101.
Cy5.5 är ett nära infrarött (IR) fluorescensemitterande färgämne (excitation / utsläpp maximalt 678/694 nm).
Cy7 är en nära-IR-fluor som är osynlig för blotta ögat (excitation/emission max 750/776 nm). Det används i in vivo-bildapplikationer, liksom Cy7.5-färgämnet.
Sulfocyaninfärger bär en eller två sulfogrupper, vilket gör Cy-färgämnet vattenlösligt, men tri- och quadrisulfonerade former är tillgängliga för ännu högre vattenlöslighet.[8] PEGylation är en annan modifiering som ger hydrofilicitet, inte bara till färgämnet utan också till det märkta konjugatet.
Applikationer[redigera | redigera wikitext]

Cyaninfärger används för att märka proteiner, antikroppar, peptider, nukleinsyraprober och alla typer av andra biomolekyler som ska användas i en mängd olika fluorescensdetekteringstekniker: flödescytometri, mikroskopi (främst synligt intervall, men också UV, IR), mikroplattanalyser, mikroarrayer, samt "upplysta sonder" och in vivo-avbildning.[13]
Nukleinsyramärkning[redigera | redigera wikitext]
I mikroarrayexperiment är DNA eller RNA märkt med antingen Cy3 eller Cy5 som har syntetiserats för att bära en N-hydroxisuccinimidylester (NHS-ester) reaktiv grupp. Eftersom NHS-estrar reagerar lätt endast med alifatiska amingrupper, som nukleinsyror saknar, måste nukleotider modifieras med aminoalylgrupper. Detta görs genom att införliva aminoallylmodifierade nukleotider under syntesreaktioner. Ett bra förhållande är en etikett på var 60:e bas så att etiketterna inte är för nära varandra, vilket skulle resultera i släckningseffekter.
Proteinmärkning[redigera | redigera wikitext]
För proteinmärkning bär Cy3- och Cy5-färgämnen ibland en succinimidylgrupp för att reagera med aminer, eller en maleimidgrupp för att reagera med en sulfhydrylgrupp av cysteinrester.
Cy5 är känslig för sin elektroniska miljö. Förändringar i konformationen av proteinet det är fäst vid kommer att ge antingen förbättring eller släckning av emissionen. Hastigheten för denna förändring kan mätas för att bestämma enzymkinetiska parametrar. Färgämnena kan användas för liknande ändamål i FRET-experiment.
Cy3 och Cy5 används i proteomikexperiment så att prover från två källor kan blandas och köras ihop genom separationsprocessen.[14][15] Detta eliminerar variationer på grund av olika experimentella förhållanden som är oundvikliga om proverna kördes separat. Dessa variationer gör det extremt svårt, om inte omöjligt, att använda datorer för att automatisera insamlingen av data efter att separationen är klar. Att använda dessa färgämnen gör automatiseringen trivial.
Referenser[redigera | redigera wikitext]
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Cyanine, 2 oktober 2022.
Noter[redigera | redigera wikitext]
- ^ Kvach, Maksim V.; Ustinov, Alexey V.; Stepanova, Irina A.; Malakhov, Andrei D.; Skorobogatyi, Mikhail V.; Shmanai, Vadim V.; Korshun, Vladimir A. (2008). ”A Convenient Synthesis of Cyanine Dyes: Reagents for the Labeling of Biomolecules” (på engelska). European Journal of Organic Chemistry 2008 (12): sid. 2107–2117. doi:. ISSN 1099-0690. https://chemistry-europe.onlinelibrary.wiley.com/doi/abs/10.1002/ejoc.200701190.
- ^ ”Cyanine dyes”. The IUPAC Compendium of Chemical Terminology. 2014. doi:
- ^ Kim, Eunha; Park, Seung Bum (2010). ”Discovery of New Synthetic Dyes: Targeted Synthesis or Combinatorial Approach?”. i Demchenko, Alexander P.. Advanced Fluorescence Reporters in Chemistry and Biology I: Fundamentals and Molecular Design Volume 8 of Springer Series on Fluorescence. Berlin: Springer. sid. 172. ISBN 9783642047022
- ^ [a b] Berneth, Horst (2008). "Methine Dyes and Pigments". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a16_487.pub2.
- ^ Ernst LA, Gupta RK, Mujumdar RB, Waggoner AS (11 maj 1989). ”Cyanine dye labeling reagents for sulfhydryl groups”. Cytometry "10" (1): ss. 3–10. doi:. PMID 2917472.
- ^ ”Archival Lifespan of TDK CD-R”. cdrom2go.com. US Digital Media. https://www.cdrom2go.com/archival-lifespan-of-tdk-cd-r. Läst 3 april 2022.
- ^ Blower MD, Feric E, Weis K, Heald R (Dec 2007). ”Genome-wide analysis demonstrates conserved localization of messenger RNAs to mitotic microtubules”. The Journal of Cell Biology 179 (7): sid. 1365–73. doi:. PMID 18166649.
- ^ [a b] CYanine dyes
- ^ [a b] Mujumdar B, Ernst A, Mujumdar SR, Lewis CJ, Waggoner AS (Mar 1993). ”Cyanine dye labeling reagents: Sulfoindocyanine succinimidyl esters”. Bioconjugate Chemistry 4 (2): sid. 105–111. doi:. PMID 7873641.
- ^ Umezawa K, Matsui A, Nakamura Y, Citterio D, Suzuki K (2009). ”Bright, color-tunable fluorescent dyes in the Vis/NIR region: establishment of new "tailor-made" multicolor fluorophores based on borondipyrromethene”. Chemistry 15 (5): sid. 1096–106. doi:. PMID 19117043.
- ^ Levitus, Marcia; Ranjit, Suman (2011). ”Cyanine dyes in biophysical research: the photophysics of polymethine fluorescent dyes in biomolecular environments” (på engelska). Quarterly Reviews of Biophysics 44 (1): sid. 123–151. doi:. ISSN 1469-8994. PMID 21108866. https://www.cambridge.org/core/journals/quarterly-reviews-of-biophysics/article/cyanine-dyes-in-biophysical-research-the-photophysics-of-polymethine-fluorescent-dyes-in-biomolecular-environments/9DC53FC6C19B19D508A1E03E21C4ADD1.
- ^ Jackson ImmunoResearch. ”Cyanine Dyes (Cy2, Cy3, and Cy5)”. http://www.jacksonimmuno.com/technical/f-cy3-5.asp. Läst 31 oktober 2008.
- ^ Armitage, Bruce A. (27 januari 2005). ”DNA Binders and Related Subjects” (på engelska). Topics in Current Chemistry 253: sid. 55–76. doi:.
- ^ Unlü M, Morgan ME, Minden JS (Oct 1997). ”Difference gel electrophoresis: a single gel method for detecting changes in protein extracts”. Electrophoresis 18 (11): sid. 2071–7. doi:. PMID 9420172.
- ^ Osterman IA, Ustinov AV, Evdokimov DV, Korshun VA, Sergiev PV, Serebryakova MV, Demina IA, Galyamina MA, Govorun VM, Dontsova OA (Jan 2013). ”A nascent proteome study combining click chemistry with 2DE”. Proteomics 13 (1): sid. 17–21. doi:. PMID 23161590. Arkiverad från originalet den 30 juni 2015. https://web.archive.org/web/20150630075256/https://www.cyandye.com/A_nascent_proteome_study_combining_click_chemistry_with_2DE.pdf. Läst 27 juni 2015.
Externa länkar[redigera | redigera wikitext]
 Wikimedia Commons har media som rör Cyaniner.
Wikimedia Commons har media som rör Cyaniner.
|
