Anisol: Skillnad mellan sidversioner
Josvebot (Diskussion | Bidrag) m WPCleaner v1.30b - Fixed using Wikipedia:SF - Mall med Unicode kontrolltecken |
tillägg av text + referenser |
||
| Rad 1: | Rad 1: | ||
{{Kemibox |
|||
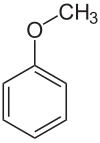
[[Bild:Anisol.svg|thumb|[[Strukturformel]] för anisol.]] |
|||
|Vardagligt namn = Anisol |
|||
'''Anisol''', metylfenyleter eller metoxibensen, C<sub>6</sub>H<sub>5</sub>·O·CH<sub>3</sub>, är en organisk [[kemisk förening]]. |
|||
|Bild = Anisol.svg |
|||
|Bildtext = Strukturformel |
|||
|Bildbredd = 100 |
|||
|Bild2 = Anisole-3D-balls.png |
|||
|Bildbredd2 = 100 |
|||
|Bild2text = |
|||
|Systematiskt namn = Metoxybenzen<ref name=iupac2013>{{cite book | title = Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book) | publisher = [[Royal Society of Chemistry|The Royal Society of Chemistry]] | date = 2014 | location = Cambridge | pages = 702–703 | doi = 10.1039/9781849733069-00648 | isbn = 978-0-85404-182-4 | quote = Anisole, C<sub>6</sub>H<sub>5</sub>-O-CH<sub>3</sub>, is the only name in the class of ethers which is retained both as a preferred IUPAC name and for use in general nomenclature. For preferred IUPAC names, no substitution is allowed; for general nomenclature substitution is allowed on the ring and on the side chain under certain conditions (see P-34.1.1.4).}}</ref> |
|||
|Övriga namn = Metylfenyleter<ref name=iupac2013/><br />Fenoxymetan |
|||
|Kemisk formel = C<sub>7</sub>H<sub>8</sub>O |
|||
|Utseende = Färglös vätska |
|||
|CAS-nummer = 100-66-3 |
|||
|SMILES = COc1ccccc1 |
|||
|Molmassa = 108,140 |
|||
|Densitet = 0,995 |
|||
|Löslighet = Olösligt |
|||
|LöslighetTemp = |
|||
|Smältpunkt = -37 |
|||
|Smältextra = |
|||
|Kokpunkt = 154 |
|||
|Kokextra = |
|||
|Huvudfara = |
|||
|NFPA704 = {{NFPA 704|Hälsa=1|Eldfarlighet=2|Reaktivitet=0|Andra= }} |
|||
|LD50 = 3 700 mg/kg (råtta, oralt) |
|||
|}} |
|||
'''Anisol''' eller '''metoxibensen''', C<sub>6</sub>H<sub>5</sub>·O·CH<sub>3</sub>, är en organisk [[kemisk förening]]. Det är en färglös vätska med en lukt som påminner om anisfrö och i själva verket finns många av dess derivat i naturliga och konstgjorda dofter. Föreningen tillverkas huvudsakligen syntetiskt och är en insatsprodukt till andra syntetiska föreningar. Det är en [[Eter (kemikalie)|eter]]. Anisol är ett standardreagens av både praktiskt och pedagogiskt värde.<ref>Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1</ref> |
|||
{{orgkemistub}} |
|||
Det kan framställas genom Williamson-etersyntesen där [[natriumfenoxid]] reageras med en [[metylhalogenid]] för att ge anisol. |
|||
==Reaktivitet== |
|||
Anisol genomgår elektrofil aromatisk substitutionsreaktion med snabbare hastighet än [[bensen]], som i sin tur reagerar snabbare än [[nitrobensen]]. [[Metoxigrupp]]en är en orto/para-styrgrupp, vilket innebär att elektrofil substitution företrädesvis förekommer på dessa tre platser. Den förbättrade nukleofiliciteten hos anisol kontra bensen återspeglar påverkan av metoxigruppen, vilket gör ringen mer [[elektron]]rik. Metoxigruppen påverkar starkt ringens pi-moln som en mesomer elektrondonator, mer än som en induktiv elektronuttagsgrupp trots [[syre]]ts elektronegativitet. Uttryckt mer kvantitativt är Hammettkonstanten för para-substitution av anisol -0,27. |
|||
Illustrativt för dess nukleofilicitet reagerar anisol med [[ättiksyraanhydrid]] för att ge 4-metoxiacetofenon: |
|||
:CH<sub>3</sub>OC<sub>6</sub>H<sub>5</sub> + (CH<sub>3</sub>CO)<sub>2</sub>O →CH<sub>3</sub>OC<sub>6</sub>H<sub>4</sub>C(O)CH<sub>3</sub> +CH<sub>3</sub>CO<sub>2</sub>H |
|||
Till skillnad från de flesta acetofenoner, men med återgivning av påverkan av metoxigruppen, genomgår metoxiacetofenon en andra [[acetylering]]. Många relaterade reaktioner har påvisats. Till exempel omvandlar P<sub>4</sub>S<sub>10</sub> anisol till [[Lawessons reagens]], |
|||
[(CH<sub>3</sub>OC<sub>6</sub>H<sub>4</sub>)PS<sub>2</sub>]<sub>2</sub>.<ref>{{cite journal |doi=10.15227/orgsyn.062.0158|title=Thiation with 2,4-Bis(4-Methoxyphenyl)-1,3,2,4- Dithiadiphosphetane 2,4-Disulfide: N-Methylthiopyrrolidone|journal=Organic Syntheses|year=1984|volume=62|page=158|author=Thomsen, K. Clausen, S. Scheibye, S.-O. Lawesson}}</ref> |
|||
Anisol har också en elektronrik ring och bildar lätt π-komplex med metallkarbonyler, t.ex. Cr (η 6-anisole) (CO)<sub>3</sub>.<ref name=PK>{{cite journal|journal=Topics Organomet Chem.|year=2004| volume=7|pages=3–20|doi=10.1007/b94489|title=Synthesis of Transition Metal η<sup>6</sup>-Arene Complexes|author=E. Peter Kündig|series=Topics in Organometallic Chemistry|isbn=978-3-540-01604-5}}</ref> |
|||
Eterbindningen är mycket stabil, men metylgruppen kan avlägsnas med hydrojodsyra: |
|||
:CH<sub>3</sub>OC<sub>6</sub>H<sub>5</sub> + HI → HOC<sub>6</sub>H<sub>5</sub> + CH<sub>3</sub>I |
|||
[[Birchreduktion]] av anisol ger 1-metoxicyklohexa-1,4-dien.<ref>{{cite journal |doi=10.15227/orgsyn.057.0107|title=Tricarbonyl[(2,3,4,5-η)-2,4-Cyclohexadien-1-one]Iron and Tricarbonyl[(1,2,3,4,5-η)-2-Methoxy-2,4-Cyclohexadien-1-yl]Iron(1+) Hexafluorophosphate(1−) from Anisole|journal=Organic Syntheses|year=1977|volume=57|page=107|author=A. J. Birch and K. B. Chamberlain}}</ref> |
|||
==Framställning== |
|||
Anisol framställs genom metylering av natriumfenoxid med [[dimetylsulfat]] eller [[metylklorid]]:<ref>G. S. Hiers and F. D. Hager (1929). "Anisole". Organic Syntheses. 9: 12. doi:10.15227/orgsyn.009.0012</ref><ref name=Ullmann/> |
|||
: 2 C<sub>6</sub>H<sub>5</sub>O<sup>−</sup>Na<sup>+</sup> + (CH<sub>3</sub>O)<sub>2</sub>SO<sub>2</sub> → 2 C<sub>6</sub>H<sub>5</sub>OCH<sub>3</sub> + Na<sub>2</sub>SO<sub>4</sub> |
|||
==Användning== |
|||
Anisol är en insatsprodukt till [[parfym]]er, insektsferomoner och läkemedel.<ref name=Ullmann>Helmut Fiege, Heinz-Werner Voges, Toshikazu Hamamoto, Sumio Umemura, Tadao Iwata, Hisaya Miki, Yasuhiro Fujita, Hans-Josef Buysch, Dorothea Garbe, Wilfried Paulus “Phenol Derivatives“ in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. {{DOI|10.1002/14356007.a19_313}}</ref> Till exempel framställs syntetiskt anetol från anisol. |
|||
==Säkerhet== |
|||
Anisole är relativt giftfri med en LD<sub>50</sub> på 3 700 mg/kg hos [[råttor]].<ref name=MSDS>[http://www.seas.upenn.edu/~nanofab/chemicals/MSDS_Solvent_Anisole.pdf MSDS] {{webarchive |url=https://web.archive.org/web/20100701184343/http://www.seas.upenn.edu/~nanofab/chemicals/MSDS_Solvent_Anisole.pdf |date=July 1, 2010 }}</ref> Dess största fara är dess brandfarlighet.<ref name=MSDS/> |
|||
==Se även== |
|||
* [[Anetol]] |
|||
* [[Butylhydroxianisol]] |
|||
* [[Eter (kemikalie)|Eter]] |
|||
* [[Fenol]] |
|||
==Referenser== |
|||
{{enwp|url=https://en.wikipedia.org/w/index.php?title=Anisole&oldid=1068140526 |artikel=Anisole|datum=26 januari 2022 }} |
|||
===Noter=== |
|||
<references> |
|||
</references> |
|||
==Externa länkar== |
|||
{{Commonscat|Anisole}} |
|||
* [http://www.pherobase.com/database/compound/compounds-detail-anisole.php Pherobase] pheromone database entry |
|||
{{Auktoritetsdata}} |
|||
{{STANDARDSORTERING:Anisol}} |
|||
[[Kategori:Aromer]] |
[[Kategori:Aromer]] |
||
Versionen från 24 september 2022 kl. 14.53
| Anisol | |
  | |
| Systematiskt namn | Metoxybenzen[1] |
|---|---|
| Övriga namn | Metylfenyleter[1] Fenoxymetan |
| Kemisk formel | C7H8O |
| Molmassa | 108,140 g/mol |
| Utseende | Färglös vätska |
| CAS-nummer | 100-66-3 |
| SMILES | COc1ccccc1 |
| Egenskaper | |
| Densitet | 0,995 g/cm³ |
| Löslighet (vatten) | Olösligt g/l |
| Smältpunkt | -37 °C |
| Kokpunkt | 154 °C |
| Faror | |
| NFPA 704 | |
| LD50 | 3 700 mg/kg (råtta, oralt) |
| SI-enheter & STP används om ej annat angivits | |
Anisol eller metoxibensen, C6H5·O·CH3, är en organisk kemisk förening. Det är en färglös vätska med en lukt som påminner om anisfrö och i själva verket finns många av dess derivat i naturliga och konstgjorda dofter. Föreningen tillverkas huvudsakligen syntetiskt och är en insatsprodukt till andra syntetiska föreningar. Det är en eter. Anisol är ett standardreagens av både praktiskt och pedagogiskt värde.[2]
Det kan framställas genom Williamson-etersyntesen där natriumfenoxid reageras med en metylhalogenid för att ge anisol.
Reaktivitet
Anisol genomgår elektrofil aromatisk substitutionsreaktion med snabbare hastighet än bensen, som i sin tur reagerar snabbare än nitrobensen. Metoxigruppen är en orto/para-styrgrupp, vilket innebär att elektrofil substitution företrädesvis förekommer på dessa tre platser. Den förbättrade nukleofiliciteten hos anisol kontra bensen återspeglar påverkan av metoxigruppen, vilket gör ringen mer elektronrik. Metoxigruppen påverkar starkt ringens pi-moln som en mesomer elektrondonator, mer än som en induktiv elektronuttagsgrupp trots syrets elektronegativitet. Uttryckt mer kvantitativt är Hammettkonstanten för para-substitution av anisol -0,27.
Illustrativt för dess nukleofilicitet reagerar anisol med ättiksyraanhydrid för att ge 4-metoxiacetofenon:
- CH3OC6H5 + (CH3CO)2O →CH3OC6H4C(O)CH3 +CH3CO2H
Till skillnad från de flesta acetofenoner, men med återgivning av påverkan av metoxigruppen, genomgår metoxiacetofenon en andra acetylering. Många relaterade reaktioner har påvisats. Till exempel omvandlar P4S10 anisol till Lawessons reagens, [(CH3OC6H4)PS2]2.[3]
Anisol har också en elektronrik ring och bildar lätt π-komplex med metallkarbonyler, t.ex. Cr (η 6-anisole) (CO)3.[4]
Eterbindningen är mycket stabil, men metylgruppen kan avlägsnas med hydrojodsyra:
- CH3OC6H5 + HI → HOC6H5 + CH3I
Birchreduktion av anisol ger 1-metoxicyklohexa-1,4-dien.[5]
Framställning
Anisol framställs genom metylering av natriumfenoxid med dimetylsulfat eller metylklorid:[6][7]
- 2 C6H5O−Na+ + (CH3O)2SO2 → 2 C6H5OCH3 + Na2SO4
Användning
Anisol är en insatsprodukt till parfymer, insektsferomoner och läkemedel.[7] Till exempel framställs syntetiskt anetol från anisol.
Säkerhet
Anisole är relativt giftfri med en LD50 på 3 700 mg/kg hos råttor.[8] Dess största fara är dess brandfarlighet.[8]
Se även
Referenser
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Anisole, 26 januari 2022.
Noter
- ^ [a b] Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. Sid. 702–703. doi:. ISBN 978-0-85404-182-4. ”Anisole, C6H5-O-CH3, is the only name in the class of ethers which is retained both as a preferred IUPAC name and for use in general nomenclature. For preferred IUPAC names, no substitution is allowed; for general nomenclature substitution is allowed on the ring and on the side chain under certain conditions (see P-34.1.1.4).”
- ^ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Thomsen, K. Clausen, S. Scheibye, S.-O. Lawesson (1984). ”Thiation with 2,4-Bis(4-Methoxyphenyl)-1,3,2,4- Dithiadiphosphetane 2,4-Disulfide: N-Methylthiopyrrolidone”. Organic Syntheses 62: sid. 158. doi:.
- ^ E. Peter Kündig (2004). ”Synthesis of Transition Metal η6-Arene Complexes”. Topics Organomet Chem.. Topics in Organometallic Chemistry 7: sid. 3–20. doi:. ISBN 978-3-540-01604-5.
- ^ A. J. Birch and K. B. Chamberlain (1977). ”Tricarbonyl[(2,3,4,5-η)-2,4-Cyclohexadien-1-one]Iron and Tricarbonyl[(1,2,3,4,5-η)-2-Methoxy-2,4-Cyclohexadien-1-yl]Iron(1+) Hexafluorophosphate(1−) from Anisole”. Organic Syntheses 57: sid. 107. doi:.
- ^ G. S. Hiers and F. D. Hager (1929). "Anisole". Organic Syntheses. 9: 12. doi:10.15227/orgsyn.009.0012
- ^ [a b] Helmut Fiege, Heinz-Werner Voges, Toshikazu Hamamoto, Sumio Umemura, Tadao Iwata, Hisaya Miki, Yasuhiro Fujita, Hans-Josef Buysch, Dorothea Garbe, Wilfried Paulus “Phenol Derivatives“ in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a19_313
- ^ [a b] MSDS Arkiverad July 1, 2010
Externa länkar
|

