Brucin: Skillnad mellan sidversioner
korr |
tillägg av text + referenser |
||
| Rad 9: | Rad 9: | ||
|Övriga namn = 10,11-Dimetoxistryknin |
|Övriga namn = 10,11-Dimetoxistryknin |
||
|Kemisk formel = [[kol|C]]<sub>23</sub>[[väte|H]]<sub>26</sub>[[kväve|N]]<sub>2</sub>[[syre|O]]<sub>4</sub> |
|Kemisk formel = [[kol|C]]<sub>23</sub>[[väte|H]]<sub>26</sub>[[kväve|N]]<sub>2</sub>[[syre|O]]<sub>4</sub> |
||
|Utseende = |
|Utseende = Färglösa kristaller |
||
|CAS-nummer = 357-57-3 |
|CAS-nummer = 357-57-3 |
||
|SMILES = COC1=C(C=C2C(=C1)[C@]34C<br>CN5[C@H]3C[C@@H]6[C@@H]7<br>[C@@H]4N2C(=O)C[C@@H]7OCC=C6C5)OC |
|SMILES = COC1=C(C=C2C(=C1)[C@]34C<br>CN5[C@H]3C[C@@H]6[C@@H]7<br>[C@@H]4N2C(=O)C[C@@H]7OCC=C6C5)OC |
||
| Rad 23: | Rad 23: | ||
|LD50 = 4,0 mg/kg (Kanin via oralt intag) |
|LD50 = 4,0 mg/kg (Kanin via oralt intag) |
||
|}} |
|}} |
||
'''Brucin''' är en besk [[alkaloid]] nära besläktad med [[stryknin]]. Brucin kan påträffas i vissa växter – mest kända är [[rävkaketräd]]et och [[ignatiusbönan]] – och är 40 gånger mindre giftigt än stryknin. |
'''Brucin''' är en besk [[alkaloid]] nära besläktad med [[stryknin]]. Brucin kan påträffas i vissa växter – mest kända är [[rävkaketräd]]et och [[ignatiusbönan]] – och är 40 gånger mindre giftigt än stryknin. |
||
Ämnet bildar färglösa kristalltavlor, som är lättlösliga i [[etanol]] och [[Dietyleter|eter]] men sämre i vatten. Den har användning inom |
Ämnet bildar färglösa kristalltavlor, som är lättlösliga i [[etanol]] och [[Dietyleter|eter]] men sämre i vatten. Den har användning inom [[Medicinsk specialitet|medicin]]en,<ref>Meyers varulexikon, Forum, 1952</ref> samt för denaturering av etanol. |
||
== |
==Historik== |
||
Brucine upptäcktes 1819 av ''Pelletier och Caventou'' i barken på [[Strychnos nux-vomica]]-trädet.<ref>{{cite book|last1=Wormley|first1=T|title=Micro-chemistry of poisons including their physiological, pathological, and legal relations : Adapted to the use of the medical jurist, physician, and general chemist.|url=https://archive.org/details/microchemis01worm|date=1869|publisher=W. Wood|location=New York}}</ref> Även om dess struktur inte härleddes förrän mycket senare, bestämdes det 1884 att den var nära besläktad med stryknin, då kemisten Hanssen omvandlade både stryknin och brucin till samma molekyl.<ref>{{cite book|last1=Buckingham|first1=J|title=Bitter Nemesis: The Intimate History of Strychnine|date=2007|publisher=CRC Press|page=225}}</ref> |
|||
<References/> |
|||
Brucine kan detekteras och kvantifieras med hjälp av [[vätskekromatografi]]-[[masspektrometri]].<ref>{{cite journal|last1=Teske|first1=J|last2=Weller|first2=J|last3=Albrecht|first3=U|last4=Fieguth|first4=A|title=Fatal Intoxication Due to Brucine|journal=Journal of Analytical Toxicology|date=2011|volume=35|issue=4|pages=248–253|doi=10.1093/anatox/35.4.248|pmid=21513620|doi-access=free}}</ref> Historiskt sett skildes brucin från stryknin genom sin reaktivitet mot [[kromsyra]].<ref>{{cite book|last1=Glasby|first1=J.|title=Encyclopedia of the alkaloids|url=https://archive.org/details/encyclopediaofal0000glas|url-access=registration|date=1975|publisher=Plenum Press|location=New York|page=214|isbn=9780306308451}}</ref> |
|||
==Användning== |
|||
===Kemiska tillämpningar=== |
|||
Eftersom brucin är en stor kiral molekyl har den använts i kiral upplösning. ''Fisher'' rapporterade 1899 först dess användning som ett [[lösningsmedel]] och det var den första naturliga produkten som 1904 användes av ''Marckwald'' som organokatalysator i en reaktion som resulterade i en enantiomerisk anrikning.<ref>{{cite book|last1=Koskinen|first1=A|title=Asymmetric synthesis of natural products|url=https://archive.org/details/asymmetricsynthe0000kosk|url-access=registration|date=1993|publisher=J. Wiley|location=Chichester|pages=[https://archive.org/details/asymmetricsynthe0000kosk/page/17 17], 28–29}}</ref> Dess bromidsalt har använts som den stationära fasen i [[HPLC]] för att selektivt binda en av två anjoniska enantiomerer.<ref>{{cite journal|last1=Zarbua|first1=K|last2=Kral|first2=V|title=Quaternized brucine as a novel chiral selector|journal=Tetrahedron: Asymmetry|year=2002|pages=2567–2570|doi=10.1016/s0957-4166(02)00715-2|volume=13|issue=23}}</ref> Brucin har också använts i fraktionerad destillation i [[aceton]] för att lösa dihydroxifettsyror,<ref>{{cite journal|last1=Malkar|first1=N|last2=Kumar|first2=V|title=Optical resolution of (±)-Threo-9,10,16-trihydroxy hexadecanoic acid using (−)brucine|journal=Journal of the American Oil Chemists' Society|date=1998|volume=75|issue=10|pages=1461–1463|doi=10.1007/s11746-998-0202-9|s2cid=83662051}}</ref> samt diarylkarbinoler.<ref>{{cite journal|last1=Toda|first1=F|last2=Tanaka|first2=K|last3=Koshiro|first3=K|title=A New Preparative Method for Optically Active Diarylcarbinols|journal=Tetrahedron: Asymmetry|date=1991|volume=2|issue=9|pages=873–874|doi=10.1016/s0957-4166(00)82198-9}}</ref> |
|||
===Medicinska tillämpningar=== |
|||
Medan brucin har visat sig ha goda antitumöreffekter, på både hepatocellulärt [[karcinom]]<ref>{{cite journal|last1=Qin|first1=J|title=Anti-Tumor Effects of Brucine Immune-Nanoparticles on Hepatocellular Carcinoma|journal=International Journal of Nanomedicine|date=2012|volume=7|pages=369–379|doi=10.2147/IJN.S27226|pmid=22334771|pmc=3273973}}</ref> och [[bröstcancer]],<ref>{{cite journal|last1=Serasanambati|first1=M|last2=Chilakapati|first2=S|last3=Vanagavaragu|first3=J|last4=Cilakapati|first4=D|title=Inhibitory effect of gemcitabine and brucine on MDA MB-231 human breast cancer cells|journal=International Journal of Drug Delivery|date=2014|volume=6|url=http://www.arjournals.org/index.php/ijdd/article/view/1422}}</ref> har dess smala terapeutiska fönster begränsat dess användning som behandling för [[cancer]]. |
|||
Brucin används också i traditionell kinesisk medicin som ett [[antiinflammatorisk]]t och [[smärtstillande läkemedel]],<ref>{{cite journal|last1=Zhang|first1=J|last2=Wang|first2=S|last3=Chen|first3=X|last4=Zhide|first4=H|last5=Xiao|first5=M|title=Capillary Electrophorese with Field-Enhanced Stacking for Rapid and Sensitive Determination of Strychnine and Brucine|journal=Analytical and Bioanalytical Chemistry|date=2003|volume=376|issue=2|pages=210–213|doi=10.1007/s00216-003-1852-y|pmid=12692702|s2cid=7832819}}</ref> samt i vissa [[ayurveda]] och [[homeopati]]läkemedel.<ref>{{cite journal|last1=Rathi|first1=A|last2=Srivastava|first2=N|last3=Khatoon|first3=S|last4=Rawat|first4=A|title=TLC Determination of Strychnine and Brucine of Strychnos nun vomica in Ayurveda and Homeopathy Drugs|journal=Chromatographia|date=2008|pages=607–613|doi=10.1365/s10337-008-0556-z|volume=67|issue=7–8|s2cid=94626190}}</ref> |
|||
===Denaturering av alkohol=== |
|||
Brucine är en av de många kemikalier som används som [[denatureringsmedel]] för att göra [[alkohol]] olämplig för konsumtion.<ref name = "cornell">{{cite web |url= https://www.law.cornell.edu/cfr/text/27/21.151|title= List of denaturants authorized for denatured spirits|date=30 August 2016|website= www.law.cornell.edu|publisher= Cornell Law School|access-date= 2019-08-24}}</ref> |
|||
==Säkerhet== |
|||
Brucinförgiftning uppträder mycket sällan, eftersom det vanligtvis intas tillsammans med stryknin. Symtom på brucinförgiftning är [[muskelspasmer]], [[kramper]], [[rabdomyolys]] och akut njurskada. Brucins verkningsmekanism liknar den hos stryknin. Det fungerar som en antagonist vid glycinreceptorer och förlamar hämmande [[neuroner]]. |
|||
Den sannolika dödliga dosen av brucin hos vuxna är 1 g.<ref>{{cite book|last1=Gosselin|first1=R. E.|last2=Smith|first2=R. P.|last3=Hodge|first3=H. C.|title=Clinical Toxicology of Commercial Products|date=1984|publisher=Williams & Wilkins|location=Baltimore/London|edition=5}}</ref> Hos andra djur varierar LD50 avsevärt. |
|||
{| class="wikitable" |
|||
|- |
|||
! Djur !! Intagsväg !! LD<sub>50</sub><ref>{{cite web | url = https://toxnet.nlm.nih.gov/cgi-bin/sis/search2/f?./temp/~W5wHBo:2 | title = Brucine | website = TOXNET | publisher = NIH | access-date = 2018-10-07}}</ref> |
|||
|- |
|||
| Mus || [[Subkutan]] || 60 mg/kg |
|||
|- |
|||
| Råtta || [[Intraperitoneal]] || 91 mg/kg |
|||
|- |
|||
| Kanin || [[Peroral]] || 4 mg/kg |
|||
|} |
|||
==Referenser== |
|||
{{enwp|url=https://en.wikipedia.org/w/index.php?title=Brucine&oldid=1102715072|artikel=Brucine|datum=6 augusti 2022 }} |
|||
* Säkerhetsdatablad Brucin, Fisher Scientific A |
* Säkerhetsdatablad Brucin, Fisher Scientific A |
||
===Noter=== |
|||
<references> |
|||
</references> |
|||
==Externa länkar== |
==Externa länkar== |
||
{{Commonscat|Brucine }} |
|||
* [http://www.inchem.org/documents/pims/chemical/brucine.htm#SectionTitle:1.1 Brucine], INCHEM.org |
* [http://www.inchem.org/documents/pims/chemical/brucine.htm#SectionTitle:1.1 Brucine], INCHEM.org |
||
{{Auktoritetsdata}} |
|||
{{STANDARDSORTERING:Brucin}} |
|||
[[Kategori:Alkaloider]] |
[[Kategori:Alkaloider]] |
||
| Rad 38: | Rad 82: | ||
[[Kategori:Beska föreningar]] |
[[Kategori:Beska föreningar]] |
||
[[Kategori:Fenoletrar]] |
[[Kategori:Fenoletrar]] |
||
{{orgkemistub}} |
|||
Versionen från 19 oktober 2022 kl. 16.12
| Brucin | |
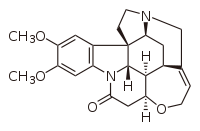 | |
| Systematiskt namn | 2,3-Dimetoxistryknin |
|---|---|
| Övriga namn | 10,11-Dimetoxistryknin |
| Kemisk formel | C23H26N2O4 |
| Molmassa | 394,46 g/mol |
| Utseende | Färglösa kristaller |
| CAS-nummer | 357-57-3 |
| SMILES | COC1=C(C=C2C(=C1)[C@]34C CN5[C@H]3C[C@@H]6[C@@H]7 [C@@H]4N2C(=O)C[C@@H]7OCC=C6C5)OC |
| Egenskaper | |
| Löslighet (vatten) | 0,8 g/l (20 °C) |
| Smältpunkt | -176 °C |
| Faror | |
| Huvudfara | Inandning, förtäring, hudkontakt |
| LD50 | 4,0 mg/kg (Kanin via oralt intag) |
| SI-enheter & STP används om ej annat angivits | |
Brucin är en besk alkaloid nära besläktad med stryknin. Brucin kan påträffas i vissa växter – mest kända är rävkaketrädet och ignatiusbönan – och är 40 gånger mindre giftigt än stryknin.
Ämnet bildar färglösa kristalltavlor, som är lättlösliga i etanol och eter men sämre i vatten. Den har användning inom medicinen,[1] samt för denaturering av etanol.
Historik
Brucine upptäcktes 1819 av Pelletier och Caventou i barken på Strychnos nux-vomica-trädet.[2] Även om dess struktur inte härleddes förrän mycket senare, bestämdes det 1884 att den var nära besläktad med stryknin, då kemisten Hanssen omvandlade både stryknin och brucin till samma molekyl.[3]
Brucine kan detekteras och kvantifieras med hjälp av vätskekromatografi-masspektrometri.[4] Historiskt sett skildes brucin från stryknin genom sin reaktivitet mot kromsyra.[5]
Användning
Kemiska tillämpningar
Eftersom brucin är en stor kiral molekyl har den använts i kiral upplösning. Fisher rapporterade 1899 först dess användning som ett lösningsmedel och det var den första naturliga produkten som 1904 användes av Marckwald som organokatalysator i en reaktion som resulterade i en enantiomerisk anrikning.[6] Dess bromidsalt har använts som den stationära fasen i HPLC för att selektivt binda en av två anjoniska enantiomerer.[7] Brucin har också använts i fraktionerad destillation i aceton för att lösa dihydroxifettsyror,[8] samt diarylkarbinoler.[9]
Medicinska tillämpningar
Medan brucin har visat sig ha goda antitumöreffekter, på både hepatocellulärt karcinom[10] och bröstcancer,[11] har dess smala terapeutiska fönster begränsat dess användning som behandling för cancer.
Brucin används också i traditionell kinesisk medicin som ett antiinflammatoriskt och smärtstillande läkemedel,[12] samt i vissa ayurveda och homeopatiläkemedel.[13]
Denaturering av alkohol
Brucine är en av de många kemikalier som används som denatureringsmedel för att göra alkohol olämplig för konsumtion.[14]
Säkerhet
Brucinförgiftning uppträder mycket sällan, eftersom det vanligtvis intas tillsammans med stryknin. Symtom på brucinförgiftning är muskelspasmer, kramper, rabdomyolys och akut njurskada. Brucins verkningsmekanism liknar den hos stryknin. Det fungerar som en antagonist vid glycinreceptorer och förlamar hämmande neuroner.
Den sannolika dödliga dosen av brucin hos vuxna är 1 g.[15] Hos andra djur varierar LD50 avsevärt.
| Djur | Intagsväg | LD50[16] |
|---|---|---|
| Mus | Subkutan | 60 mg/kg |
| Råtta | Intraperitoneal | 91 mg/kg |
| Kanin | Peroral | 4 mg/kg |
Referenser
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Brucine, 6 augusti 2022.
- Säkerhetsdatablad Brucin, Fisher Scientific A
Noter
- ^ Meyers varulexikon, Forum, 1952
- ^ Wormley, T (1869). Micro-chemistry of poisons including their physiological, pathological, and legal relations : Adapted to the use of the medical jurist, physician, and general chemist.. New York: W. Wood. https://archive.org/details/microchemis01worm.
- ^ Buckingham, J (2007). Bitter Nemesis: The Intimate History of Strychnine. CRC Press. Sid. 225.
- ^ Teske, J; Weller, J; Albrecht, U; Fieguth, A (2011). ”Fatal Intoxication Due to Brucine”. Journal of Analytical Toxicology 35 (4): sid. 248–253. doi:. PMID 21513620.
- ^ Glasby, J. (1975). Encyclopedia of the alkaloids. New York: Plenum Press. Sid. 214. ISBN 9780306308451. https://archive.org/details/encyclopediaofal0000glas.
- ^ Koskinen, A (1993). Asymmetric synthesis of natural products. Chichester: J. Wiley. Sid. 17, 28–29. https://archive.org/details/asymmetricsynthe0000kosk.
- ^ Zarbua, K; Kral, V (2002). ”Quaternized brucine as a novel chiral selector”. Tetrahedron: Asymmetry 13 (23): sid. 2567–2570. doi:.
- ^ Malkar, N; Kumar, V (1998). ”Optical resolution of (±)-Threo-9,10,16-trihydroxy hexadecanoic acid using (−)brucine”. Journal of the American Oil Chemists' Society 75 (10): sid. 1461–1463. doi:.
- ^ Toda, F; Tanaka, K; Koshiro, K (1991). ”A New Preparative Method for Optically Active Diarylcarbinols”. Tetrahedron: Asymmetry 2 (9): sid. 873–874. doi:.
- ^ Qin, J (2012). ”Anti-Tumor Effects of Brucine Immune-Nanoparticles on Hepatocellular Carcinoma”. International Journal of Nanomedicine 7: sid. 369–379. doi:. PMID 22334771.
- ^ Serasanambati, M; Chilakapati, S; Vanagavaragu, J; Cilakapati, D (2014). ”Inhibitory effect of gemcitabine and brucine on MDA MB-231 human breast cancer cells”. International Journal of Drug Delivery 6. http://www.arjournals.org/index.php/ijdd/article/view/1422.
- ^ Zhang, J; Wang, S; Chen, X; Zhide, H; Xiao, M (2003). ”Capillary Electrophorese with Field-Enhanced Stacking for Rapid and Sensitive Determination of Strychnine and Brucine”. Analytical and Bioanalytical Chemistry 376 (2): sid. 210–213. doi:. PMID 12692702.
- ^ Rathi, A; Srivastava, N; Khatoon, S; Rawat, A (2008). ”TLC Determination of Strychnine and Brucine of Strychnos nun vomica in Ayurveda and Homeopathy Drugs”. Chromatographia 67 (7–8): sid. 607–613. doi:.
- ^ ”List of denaturants authorized for denatured spirits”. www.law.cornell.edu. Cornell Law School. 30 August 2016. https://www.law.cornell.edu/cfr/text/27/21.151.
- ^ Gosselin, R. E.; Smith, R. P.; Hodge, H. C. (1984). Clinical Toxicology of Commercial Products (5). Baltimore/London: Williams & Wilkins.
- ^ ”Brucine”. TOXNET. NIH. https://toxnet.nlm.nih.gov/cgi-bin/sis/search2/f?./temp/~W5wHBo:2.
Externa länkar
|
