van der Waals lag
Utseende
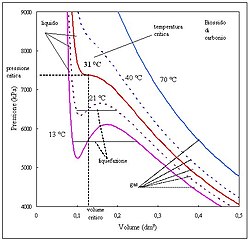
van der Waals lag är en generalisering och förbättring av den ideala gaslagen. Lagen formulerades av Johannes van der Waals och tar hänsyn till två faktorer som inte beaktas i den ideala gaslagen:
- Attraktionskraften mellan molekylerna
- Volymen för molekylerna
van der Waals lag ger en bättre beskrivning av en gas vid höga tryck då gasen blir så tät att man måste räkna med gasmolekylernas egenvolym och ta hänsyn till de små attraktiva krafter som råder mellan molekylerna.
van der Waals lag:
där
- p = tryck
- V = volym
- n = substansmängd i mol
- R = allmänna gaskonstanten (8,3145 J mol−1 K−1)
- T = absolut temperatur i kelvin
- b = volymen för molekylerna per mol. För en monoatomisk gas är det där är Avogadros konstant och van der Waalsradien
- a = växelverkan mellan molekylerna
Externa länkar
[redigera | redigera wikitext] Wikimedia Commons har media som rör Van der Waals lag.
Wikimedia Commons har media som rör Van der Waals lag.
| |||||




