Xenontrioxid
| Xenontrioxid | |
  | |
| Systematiskt namn | Xenontrioxid Xenon(VI)oxid |
|---|---|
| Övriga namn | Xenic anhydrid |
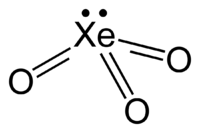
| Kemisk formel | XeO3 |
| Molmassa | 179,288 g/mol |
| Utseende | Färglösa kristaller |
| CAS-nummer | 13776-58-4 |
| SMILES | O=[Xe](=O)=O |
| Egenskaper | |
| Densitet | 4,55 g/cm³ |
| Löslighet (vatten) | Löslig |
| Smältpunkt | 25 °C (exploderar) |
| Faror | |
| Huvudfara | |
| NFPA 704 | |
| SI-enheter & STP används om ej annat angivits | |
Xenontrioxid (XeO3) är en instabil förening av xenon med oxidationstalet +6. Den ser ut som fasta, färglösa kristaller. Det är ett mycket effektivt oxidationsmedel som långsamt frigör syre (och xenon) från vatten, en process som påskyndas av solljus. Vid kontakt med organiska föreningar kan den explodera. När det detonerar frigörs xenon och syrgas.
Kemiska egenskaper[redigera | redigera wikitext]
Xenontrioxid är ett starkt oxidationsmedel och kan oxidera de flesta ämnen som överhuvudtaget är oxiderbara. Det är dock långsamt verkande och detta minskar dess användbarhet.[1]
Över 25 °C är xenontrioxid mycket benägen till våldsam explosion:
Xenontrioxid löser sig i vatten och bildar xenonsyra (H2XeO4).
Denna lösning är stabil vid rumstemperatur och saknar de explosiva egenskaperna hos xenontrioxid. Det oxiderar karboxylsyror kvantitativt till koldioxid och vatten.[2]
Alternativt löses det upp i alkaliska lösningar för att bilda xenater. HXeO−4-anjon är den dominerande arten i xenatlösningar.[3] Dessa är inte stabila och börjar fördela sig i perxenater (+8 oxidationstillstånd) och xenon och syrgas.[4] Fasta perxenater som innehåller XeO4−6 har isolerats genom att reagera XeO3 med en vattenhaltig lösning av hydroxider. Xenontrioxid reagerar med oorganiska fluorider såsom KF, RbF eller CsF för att bilda stabila fasta ämnen av formen MXeO3F.[5]
Fysiska egenskaper[redigera | redigera wikitext]
Hydrolys av xenonhexafluorid eller xenontetrafluorid ger en lösning från vilken färglösa XeO3-kristaller kan erhållas genom avdunstning.[6] Kristallerna är stabila i flera dagar i torr luft, men absorberar lätt vatten från fuktig luft för att bilda en koncentrerad lösning. Kristallstrukturen är ortorhombisk med a = 6,163 Å, b = 8,115 Å, c = 5,234 Å och 4 molekyler per enhetscell. Densiteten är 4,55 g/cm3.[7]
 |
 |

|
| boll-och-stick-modell av en del av kristallstrukturen i XeO3 |
Modell för utrymmesfyllning | koordinationsgeometri för XeO3 |
Säkerhet[redigera | redigera wikitext]
XeO3 bör hanteras med stor försiktighet. Prover har detonerat när de är ostörda i rumstemperatur. Torra kristaller reagerar explosivt med cellulosa.[7][8]
Se även[redigera | redigera wikitext]
Referenser[redigera | redigera wikitext]
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Xenon trioxide, 26 september 2022.
Noter[redigera | redigera wikitext]
- ^ Greenwood, N.; Earnshaw, A. (1997). Chemistry of the Elements. Oxford: Butterworth-Heinemann.
- ^ Jaselskis B.; Krueger R. H. (July 1966). ”Titrimetric determination of some organic acids by xenon trioxide oxidation”. Talanta 13 (7): sid. 945–949. doi:. PMID 18959958.
- ^ Peterson, J. L.; Claassen, H. H.; Appelman, E. H. (March 1970). ”Vibrational spectra and structures of xenate(VI) and perxenate(VIII) ions in aqueous solution”. Inorganic Chemistry 9 (3): sid. 619–621. doi:.
- ^ W. Henderson (2000). Main group chemistry. Great Britain: Royal Society of Chemistry. Sid. 152–153. ISBN 0-85404-617-8. https://archive.org/details/maingroupchemist00hend_891.
- ^ Egon Wiberg; Nils Wiberg; Arnold Frederick Holleman (2001). Inorganic chemistry. Academic Press. Sid. 399. ISBN 0-12-352651-5.
- ^ John H. Holloway; Eric G. Hope (1998). A. G. Sykes. red. Recent Advances in Noble-gas Chemistry. Advances in Inorganic Chemistry, Volume 46. Academic Press. Sid. 65. ISBN 0-12-023646-X.
- ^ [a b] Templeton, D. H.; Zalkin, A.; Forrester, J. D.; Williamson, S. M. (1963). ”Crystal and Molecular Structure of Xenon Trioxide”. Journal of the American Chemical Society 85 (6): sid. 817. doi:. https://escholarship.org/uc/item/4d31b0pf.
- ^ Bartlett, N.; Rao, P. R. (1963). ”Xenon Hydroxide: an Experimental Hazard”. Science 139 (3554): sid. 506. doi:. PMID 17843880. Bibcode: 1963Sci...139..506B.
Externa länkar[redigera | redigera wikitext]
 Wikimedia Commons har media som rör Xenontrioxid.
Wikimedia Commons har media som rör Xenontrioxid.- Webelements periodic table: page on Xenon(VI) oxide


