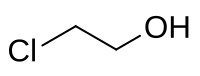
2-Kloretanol
| Kloretanol | |
  | |
| Systematiskt namn | 2-Kloretanol |
|---|---|
| Övriga namn | Kloretanol, 2-klor-1-etanol, 2-kloretan-1-ol |
| Kemisk formel | C2H4ClOH |
| Molmassa | 80,52 g/mol |
| Utseende | Färglös vätska |
| CAS-nummer | 107-07-3 |
| SMILES | ClCCO |
| Egenskaper | |
| Densitet | 1,201 g/cm³ |
| Löslighet (vatten) | Blandbar |
| Smältpunkt | -67,5 °C |
| Kokpunkt | 129 °C |
| Faror | |
| Huvudfara | |
| NFPA 704 | |
| LD50 | 71 mg/kg (råtta) 81 mg/kg (mus) 110 mg/kg (marsvin) |
| SI-enheter & STP används om ej annat angivits | |
2-Kloretanol är en klororganisk förening med formeln C2H4ClOH.
Framställning[redigera | redigera wikitext]
Kloretanol kan framställas genom halogenering av etylenglykol (C2H4(OH)2) med saltsyra (HCl).
Den kan också framställas genom att reagera etylen (C2H4) med hypokloritsyra (HClO).
Användning[redigera | redigera wikitext]
Tidigare var den huvudsakliga användningen av kloretanol framställning av etenoxid (C2H4O).
Den processen har numera ersatts av miljövänligare processer där etylen oxideras direkt till etenoxid.
Kloretanol används dock fortfarande som lösningsmedel för cellulosaacetat, etylcellulosa, harts och lignin. Många färgämnen framställs också genom alkylering av anilin (C6H5NH2) med kloretanol. Det används även för tillverkning av diverse läkemedel, bekämpningsmedel och mjukgörare.
Miljöaspekter[redigera | redigera wikitext]
Kloretanol bildas när kroppen bryter ner etylendiklorid. Kloretanol bryts vidare ner till klorättiksyra. Vid förbränning bildas väteklorid och fosgen.
Källor[redigera | redigera wikitext]
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, 2-Chloroethanol, tidigare version.
- Safety data for 2-chloroethanol Oxford University



