Perklorat
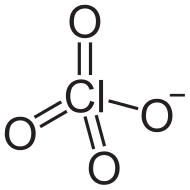

Perklorater är salter av perklorsyra och innehåller perkloratjonen ClO4–.
Egenskaper[redigera | redigera wikitext]
Perklorater är oxiderande, men är inte lika reaktiva som klorider, klorater eller hypokloriter. Detta är lite av en paradox då kloratomen i perklorat har oxidationstillstånd +7. Det är extremt högt och perklorat har också en hög redoxpotential. Men tack vare elektronerna från de fyra syreatomerna har kloratomen fullt valensskal, vilket gör den ovillig att ingå i en redox-reaktion.
Användning[redigera | redigera wikitext]
Att perklorater är stabila trots att de är starkt oxiderande har gjort att de har funnit många användningsområden som till exempel som raketbränsle, i facklor, i drivladdningar till airbags, i kemiska syregeneratorer m.m.
Inom medicin används perklorater för att behandla giftstruma. Perklorat begränsar sköldkörtelns förmåga att ta upp jod och hämmar produktionen av tyroxin.
