Selendioxid
Utseende
| Selendioxid | |
  | |
| Systematiskt namn | Selen(IV)oxid |
|---|---|
| Övriga namn | Selensyraanhydrid |
| Kemisk formel | SeO2 |
| Molmassa | 110,9588 g/mol |
| Utseende | Vita kristaller |
| CAS-nummer | 7446-08-4 |
| SMILES | O=[Se]=O |
| Egenskaper | |
| Densitet | 3,95 g/cm³ |
| Löslighet (vatten) | 384 g/l |
| Smältpunkt | 315 °C (sublimeras) |
| Faror | |
| Huvudfara | |
| SI-enheter & STP används om ej annat angivits | |
Selendioxid är en kemisk förening av selen och syre med formeln SeO2.
Egenskaper
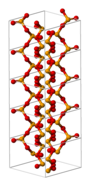
[redigera | redigera wikitext]I fast form är selendioxid en polymer med omväxlande selen- och syre-atomer. I gasform antar det samma struktur som svaveldioxid. Selendioxid är giftigt och bildar selensyrlighet vid kontakt med vatten.
Framställning
[redigera | redigera wikitext]Selendioxid kan framställas genom att oxidera selen genom förbränning i luft, med salpetersyra eller väteperoxid.
Användning
[redigera | redigera wikitext]Selendioxid används för att färga glas rött eller för att balansera den blå färg som föroreningar av kobolt ger. Den ingår också i vissa blåneringsvätskor och som toner vid framkallning.
Se även
[redigera | redigera wikitext]Källor
[redigera | redigera wikitext]- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Selenium dioxide, tidigare version.



