Vätebindning

Vätebindning är en typ av intermolekylär bindning, en kemisk bindning som verkar mellan molekyler. Den är svagare än kovalent bindning och jonbindning, vilka är bindningar mellan atomer.[1] Vätebindning brukar förklaras som en stark dipolbindning som uppstår om den positiva delen av en dipol består av en väteatom bunden till en starkt elektronegativ atom (kväve, syre eller fluor), men det är en förenkling; visserligen förekommer en dipolbindning mellan en protonerad atom, som syre, svavel eller kväve, och en motsvarande med "ledigt" elektronpar, men protonen kan "hoppa över" till den andra atomen och därmed bildas en saltbrygga eller jonbindning. I praktiken kan protonen sägas hoppa mellan dessa former.
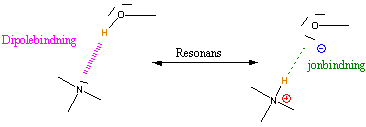
Den negativa delen av dipolen (eller protonacceptorn (Y)) består av någon av de starkt elektronegativa atomerna syre, kväve eller fluor, och den atomvätet är bundet till (eller protondonatorn (X)) utgörs av samma atomslag. Generellt kan systemet åskådliggöras på följande sätt: -X-H⋅⋅⋅⋅⋅⋅Y-, där vätebindningen symboliseras av den prickade linjen. Y och X kan vara syre, kväve, svavel eller halogenatomer.[2]
De ämnen där vätebindning förekommer är således vatten (H2O), ammoniak (NH3) och vätefluorid (HF), samt derivat av dessa såsom alkoholer och aminer som till exempel etanol (C2H5OH) och metanol (CH3OH).
En viktig konsekvens av vätebindningen är att kok- och smältpunkt för ämnen där vätebindningar uppstår mellan molekyler tenderar att vara märkbart mycket högre än för ämnen av ungefär samma molekylstorlek och molekylmassa. Relativt är den ju en svag bindning, men tack vare det stora antalet bindningar blir den samlade verkan kraftig. En annan viktig förekomst av vätebindningar är inuti vissa makromolekyler - inte minst inom biokemin, som proteiner, där vätebindningar mellan olika delar av molekylen stabiliserar dess form, och i DNA där vätebindningar mellan nukleotiderna i de olika strängarna dels håller ihop själva molekylen, dels försäkrar att rätt baspar binds samman vid kopieringen av DNA-strängarna. Vätebindningar är även mycket viktiga för cellulosastrukturen.
Utan vätebindningar hade inte liv kunnat uppstå på jorden, eftersom vatten då vid normaltemperatur hade varit en gas. Vid många biologiskt viktiga processer, t.ex. enzymkatalys, spelar vätebindningar en avgörande roll.[2]
Referenser
[redigera | redigera wikitext]- ^ March, Jerry (1977). Advanced Organic Chemistry. Reactions, Mechanisms, and Structure. McGraw-Hill. sid. 75 ff. ISBN 0-07-040247-7
- ^ [a b] Bra Böckers lexikon, 1981.
Se även
[redigera | redigera wikitext]
| ||||||||||||||||||||||||||||||||
