Glioblastom
| Glioblastom | |
| Latin: glioblastoma multiforme | |
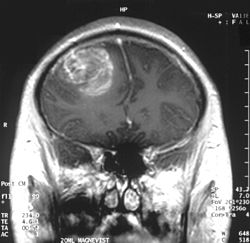 Koronar (framifrån) MRI med konstrast uppvisar ett glioblastom av WHO grad IV hos en 15 år gammal pojke | |
| Klassifikation och externa resurser | |
|---|---|
| ICD-10 | C71 |
| ICD-9 | 191 |
| ICD-O | M9440/3 |
| OMIM | 137800 |
| DiseasesDB | 29448 |
| eMedicine | neuro/147 med/2692 |
| MeSH | svensk engelsk |
Glioblastom, även känt som glioblastoma multiforme (GBM) och astrocytom grad IV, är den vanligaste och mest aggressiva cancern som har sitt ursprung i hjärnvävnad (hjärnparenkym).[1][2] Glioblastom utgör 15 % av alla hjärntumörer.[3] Den vanligaste hjärntumören överlag är meningeom, men denna uppstår ur den hinna som omger hjärnan och inte själva hjärnvävnaden.[4] Symptom är initialt icke-specifika eftersom tumören kan uppkomma i olika delar av hjärnan. Beroende på vilken del, kommer tumören ge upphov till olika symptom. Dessa symptom kan innefatta personlighetsförändring, illamående, och symptom liknande stroke.[3] Huvudvärk är sett till hela sjukdomsförloppet ett mycket vanligt symptom. Försämringen sker ofta snabbt och kan resulterar i sjunkande medvetandegrad (RLS > 4).[5]
Orsaken i de flesta fall är oklar.[5] Ovanliga riskfaktorer är genetiska sjukdomar såsom neurofibromatos och Li Fraumeni syndrom samt tidigare strålbehandling.[6][5] De kan antingen börja från normala celler i hjärnan eller utvecklas från redan befintliga låggradiga tumörer.[7] Diagnosen ställs vanligen genom en kombination av datortomografi, magnetkameraundersökning, och tumörbiopsi.[3] Vilken typ av grad som glioblastom uppnått bestäms genom biopsi. För glioblastom finns det graderna III eller IV, där IV har sämre prognos.
Det finns inget känt sätt att förebygga sjukdomen. Vanligtvis innebär behandlingen kirurgi som följs av cellgifter och Strålbehandling.[6] Läkemedlet temozolomid används ofta som en del av kemoterapi.[6][8] Höga doser av steroider kan användas för att minska mängden symptom.[3] Det är oklart om det är bäst att ta bort all eller helt enkelt det mesta av cancern.[9]
Trots bästa möjliga behandling är det vanligt att cancern recidiverar (återkommer).[6] Den vanligaste överlevnadslängden efter diagnos är 12 till 15 månader och färre än 3 till 5 % av drabbade lever längre än fem år.[6][5] Utan behandling är överlevnaden normalt 3-12 månader.[10] Under ett givet år kommer 2–3 personer per 100 000 människor att utveckla sjukdomen. [6] Vanligast börjar den vid 50–60 års ålder och den förekommer oftare hos män än hos kvinnor.[6][5] Immunterapi studeras som behandling för glioblastom.[11] Den viktigaste prognostiska faktorn är ålder.
Patologi[redigera | redigera wikitext]
Majoriteten av glioblastom uppstår de novo (med andra ord inte från ett astrocytom av lägre malignitetsgrad) och benämns då primära glioblastom. Andra glioblastom uppstår från lågmaligna astrocytom och benämns då sekundära. För sekundära glioblastom är medianåldern vid insjuknande något lägre än för primära. Det är omöjligt att histopatologiskt (i mikroskop) särskilja primärt från sekundärt glioblastom.
Gener[redigera | redigera wikitext]
Utifrån de molekylärgenetiska egenskaperna kan glioblastom delas in i fyra olika subtyper:[12] En tumör från samma patient kan dock innehålla cancerceller med flera olika subtyper beroende på vilken del av tumören som analyseras.[13] Återkommande tumörer har också visat sig kunna ha en annan subtyp än ursprungstumören.[14]
- Klassisk utgör majoriteten av primära glioblastom. De har en mutation i PTEN-tumörsuppressorgenen, deletioner i kromosom 10 och amplifering av EFGR-onkgenen. Fokal deletion av 9p21 som ger störning i CDKN2A-tumörsuppressorgenen, som är ett genlokus som kodar för två tumörsuppressorer: p16/INK4a och p14ARG, vilka påverkar funktionen hos RB respektive p53.[12]
- Proneural är typiskt för sekundär glioblastom. Mutationer i TP53 (genen som kodar för p53) och punktmutationer i isocitratdehydrogenasgenerna, IDH1 och IDH2. De har ofta överuttryck av PDGFRA. Låggradiga gliom (astrocytom grad I och II) kan också ha mutation i TP53/IDH1/IDH2.[12]
- Neurala har ofta uttryck av neurala markörer så som NEFL, GABRA1, SYT1 och SLC12A5. De kan påvisas med hjälp av immunhistokemi, in situ-hybridisering eller immunocytokemi.[12] Senare studier tyder dock på att denna subtyp består av normala hjärnceller som felaktigt analyserats som cancerceller. Det förklarar även varför det är den enda subtypen som saknar karakteristiska cancermutationer.[15]
- Mesenkymal har ofta mikrodeletion i NF1-gener som finns på kromosom 17. Gener som är involverade i TNF- och NF-κB-signalvägarna är ofta mycket uttryckta i mesenkymala glioblastom.[12]
IDH-mutation ger en onkometabolit som kallas för 2-hydroxyglutarat. 70–80 % av låggradiga gliom har denna mutation. Genom epigenetik (t.ex. metylering) kan promotorer av gener som kodar för DNA-repareringsenzym till exempel MGMT (metylguanin-DNA-metyltransferas) tystas. MGMT är viktig för att laga den kemoterapeutiska DNA-modifikationen som temozolomid gör och kommer alltså att påverka svaret på den sortens kemoterapi.[12] Därför kan patienter med MGMT ometylerade tumörer få ett bättre gensvar på temozolomid terapi. Däremot finns det inga bevis för att temozolomid bör uteslutas helt för patienter med MGMT metylerade tumörer[16].
Morfologi[redigera | redigera wikitext]
Ibland är tumören fast och vit, ibland mjuk och gul på grund av nekros och ibland förekommer mindre blödningar. Nekros sker i givna mönster med massor av närliggande celler. Celler som ligger längs med dessa regioner bildar ett mönster som kallas för pseudo-palisading. Endotelceller ligger i ett dubbellager och bildar en glomerulär kropp. VEGF från maligna astrocyter utsöndras på grund av hypoxi och bildar dessa vaskulära förändringarna. Tumörerna uppvisar ibland markörerna GFAP och Ki67.[12]
Källor[redigera | redigera wikitext]
- ^ Bleeker, Fonnet E.; Molenaar, Remco J.; Leenstra, Sieger (2012). ”Recent advances in the molecular understanding of glioblastoma”. Journal of Neuro-Oncology 108 (1): sid. 11–27. doi:. PMID 22270850.
- ^ Fagius, Jan (2006). Neurologi (4:e). sid. 236–239. Läst 1 juli 2017
- ^ [a b c d] Young, RM; Jamshidi, A; Davis, G; Sherman, JH (juni 2015). ”Current trends in the surgical management and treatment of adult glioblastoma.”. Annals of translational medicine 3 (9): sid. 121. PMID 26207249.
- ^ McNeill, Katharine A.. ”Epidemiology of Brain Tumors”. Neurologic Clinics 34 (4): sid. 981–998. doi:. http://linkinghub.elsevier.com/retrieve/pii/S0733861916300366. Läst 25 december 2016.
- ^ [a b c d e] ”Chapter 5.16”. World Cancer Report 2014. World Health Organization. 2014. ISBN 9283204298
- ^ [a b c d e f g] Gallego, O (augusti 2015). ”Nonsurgical treatment of recurrent glioblastoma.”. Current oncology (Toronto, Ont.) 22 (4): sid. e273-81. PMID 26300678.
- ^ ”Chapter 3.8”. World Cancer Report 2014. World Health Organization. 2014. ISBN 9283204298
- ^ Hart, MG; Garside, R; Rogers, G; Stein, K; Grant, R (30 april 2013). ”Temozolomide for high grade glioma.”. The Cochrane database of systematic reviews 4: sid. CD007415. PMID 23633341.
- ^ Van Meir, E. G.; Hadjipanayis, C. G.; Norden, A. D.; Shu, H. K.; Wen, P. Y.; Olson, J. J. (2010). ”Exciting New Advances in Neuro-Oncology: The Avenue to a Cure for Malignant Glioma”. CA: A Cancer Journal for Clinicians 60 (3): sid. 166–93. doi:. PMID 20445000.
- ^ Schapira, Anthony H.V. (2007). Neurology and clinical neuroscience. Philadelphia: Mosby Elsevier. sid. 1336. ISBN 9780323070539. https://books.google.ca/books?id=EwajBQAAQBAJ&pg=PA1336
- ^ ”With Immunotherapy, Glimmers of Progress against Glioblastoma”. National Cancer Institute. 9 december 2015. http://www.cancer.gov/types/brain/research/immunotherapy-glioblastoma. Läst 23 december 2015.
- ^ [a b c d e f g] Kumar, V (2015). ”The central nervous system (28)”. Robbins and Cotran pathologic basis of disease (9th). sid. 1306–1309. ISBN 978-0-8089-2450-0. Läst 1 juli 2017
- ^ Sottoriva, A.; Spiteri, I.; Piccirillo, S. G. M.; Touloumis, A.; Collins, V. P.; Marioni, J. C. (2013-03-05). ”Intratumor heterogeneity in human glioblastoma reflects cancer evolutionary dynamics” (på engelska). Proceedings of the National Academy of Sciences 110 (10): sid. 4009–4014. doi:. ISSN 0027-8424. http://www.pnas.org/cgi/doi/10.1073/pnas.1219747110. Läst 20 februari 2019.
- ^ Johnson, B. E.; Mazor, T.; Hong, C.; Barnes, M.; Aihara, K.; McLean, C. Y. (2014-01-10). ”Mutational Analysis Reveals the Origin and Therapy-Driven Evolution of Recurrent Glioma” (på engelska). Science 343 (6167): sid. 189–193. doi:. ISSN 0036-8075. PMID 24336570. PMC: PMC3998672. http://www.sciencemag.org/cgi/doi/10.1126/science.1239947. Läst 20 februari 2019.
- ^ Wang, Qianghu; Hu, Baoli; Hu, Xin; Kim, Hoon; Squatrito, Massimo; Scarpace, Lisa (2017-7). ”Tumor Evolution of Glioma-Intrinsic Gene Expression Subtypes Associates with Immunological Changes in the Microenvironment” (på engelska). Cancer Cell 32 (1): sid. 42–56.e6. doi:. https://linkinghub.elsevier.com/retrieve/pii/S1535610817302532. Läst 20 februari 2019.
- ^ Alnahhas, Iyad; Alsawas, Mouaz; Rayi, Appaji; Palmer, Joshua D.; Raval, Raju; Ong, Shirley (2020). ”Characterizing benefit from temozolomide in MGMT promoter unmethylated and methylated glioblastoma: a systematic review and meta-analysis”. Neuro-Oncology Advances 2 (1): sid. vdaa082. doi:. ISSN 2632-2498. PMID 33150334. PMC: 7596890. https://pubmed.ncbi.nlm.nih.gov/33150334. Läst 17 mars 2024.
