Svavelsyra
| Svavelsyra | |||
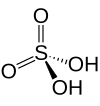  | |||
| Systematiskt namn | Svavelsyra | ||
|---|---|---|---|
| Övriga namn | Vitriololja | ||
| Kemisk formel | H2SO4 | ||
| Molmassa | 98,116 g/mol | ||
| Utseende | Färglös, något trögflytande vätska | ||
| CAS-nummer | 7664-93-9 | ||
| SMILES | OS(=O)(=O)O | ||
| Egenskaper | |||
| Densitet | 1,84 g/cm³ | ||
| Löslighet (vatten) | Blandbar | ||
| Smältpunkt | 10,4 °C | ||
| Kokpunkt | 279,6 °C | ||
| Faror | |||
| Huvudfara |
| ||
| NFPA 704 | |||
| LD50 | 2140 mg/kg | ||
| SI-enheter & STP används om ej annat angivits | |||
Svavelsyra (ett äldre trivialnamn är vitriololja) är en starkt frätande syra med kemisk beteckning H2SO4,[1] vilket kan läsas ut som divätesvaveltetraoxid. Svavelsyrans salter kallas sulfater.
Framställning[redigera | redigera wikitext]
Svavelsyra kan framställas genom att låta vatten inverka på svaveltrioxid (SO3).
Ett annat sätt är att låta syrgas inverka på svavelsyrlighet (H2SO3).
Användningsområden[redigera | redigera wikitext]
Svavelsyra används i koncentrationen 37% som elektrolyt i blyackumulatorer. Kallas ofta för batterisyra. Batterisyrans densitet är högre vid fulladdat batteri (cirka 1 265 kg/m³ vid 25 °C) än vid urladdat batteri (cirka 1 120 kg/m³ vid 25 °C).
Koncentrerad svavelsyra tar upp vatten ur luften, och används därför i vissa sammanhang för att torka luft. Om koncentrerad svavelsyra placeras i fuktig luft, kan den börja ryka genom att avdunstad svavelsyra drar åt sig så mycket vatten att syradroppar bildas, vilket gör att det ser ut som dimma ovan syraytan.
Svavelsyra reagerar med oädla metaller under utveckling av hydrogen (vätgas), och om koncentrerad svavelsyra reagerar tillsammans med koncentrerad salpetersyra, så bildas den reaktiva nitroniumjonen NO2+, som i sin tur kan reagera med olika organiska ämnen. Ett exempel är reaktionen med metanol som ger motorbränslet nitrometan. Mer generellt kan svavelsyra användas som katalysator i många esterreaktioner.
Vid elektrolytisk spjälkning av vatten till syre och väte görs vattnet elektriskt ledande genom en liten tillsats av svavelsyra.
Som livsmedelstillsats betecknas svavelsyra med E-nummer E 513.
Svavelsyra används i kombination med olika kromatsalter till att dubbelbinda en syreatom till ett derivat etc, (oxidation).
Svavelsyra används även vid tillverkning av bl a sprängämnen, gödselmedel och färgämnen.
Säkerhet[redigera | redigera wikitext]
När svavelsyra blandas med vatten sker det under kraftig värmeutveckling, vilket kan leda till kokning och därmed "sprättande" av starkt frätande vätska. Det är därför viktigt att tillämpa SIV-regeln (Syra I Vatten), alltså inte späda syra genom att hälla på vatten, utan göra vatten surt genom att hälla på syra. Men även i den riktningen sker uppvärmning, så man måste vara försiktig, även när man gör rätt.
Allmogens namn på svavelsyra[redigera | redigera wikitext]
Eftersom svavelsyra biter som eld har följande dialektala namn använts lokalt:[2]
- Fittrell (Skåne)
- Better-ell (Dalsland, Småland, Västergötland, Östergötland)
- Bettrell (Bohuslän, egentligen bitter-eld)
Se även[redigera | redigera wikitext]
Källor[redigera | redigera wikitext]
- ^ ”svavelsyra”. ne.se. https://www.ne.se/uppslagsverk/encyklopedi/l%C3%A5ng/svavelsyra. Läst 29 mars 2018.
- ^ Better-ell i Johan Ernst Rietz, Svenskt dialektlexikon (1862–1867)
- Hägg, Gunnar, Allmän och oorganisk kemi (1966), Almqvist & Wiksell
|




