Användare:Calandigary Ahmed UU/Onkolytiskt virus: Skillnad mellan sidversioner
Skapad genom översättning av "Oncolytic virus" Märken: Nutidsfras Möjligen felaktig tagg för referenslista Innehållsöversättning Innehållsöversättning2 ContentTranslation: Hög användning av omodifierad maskinöversättning |
(Ingen skillnad)
|
Versionen från 12 februari 2024 kl. 18.35
Ett onkolytiskt virus är ett virus som företrädesvis infekterar och dödar cancerceller . Eftersom de infekterade cancercellerna förstörs av onkolys frigör därefter nya infektiösa viruspartiklar eller virioner för att hjälpa till att kämpa resterande tumören. [1] [2] Förutom direkt förstörelse av tumörcellerna, onkolytiska virus kan också stimulera värdens antitumörimmunsystemsvar . [3] [4] Onkolytiska virus har också förmågan att påverka tumörens mikromiljö på flera sätt. [5] [6]
Virusens potential som medel mot cancer insågs först i början av 1900-talet, men de allra forskningsinsatser inleddes inte förrän på 1960-talet. [7] Ett antal virus inklusive adenovirus, reovirus, mässling, herpes simplex, Newcastlesjukavirus och vaccinia har testats kliniskt som onkolytiska virus. [8] De flesta av nuvarande onkolytiska virusen är konstruerade för tumörselektivitet, även om det finns naturligt förekommande exempel som reovirus och senecavirus [9] som resulterar i kliniska prövningar . [10]
Det första onkolytiska viruset som godkändes av en nationell myndighet var en omodifierade version av ECHO-7-stammen enterovirus RIGVIR, som godkändes i Lettland 2004 för behandling av hudmelanom ; [11] godkännandet drogs tillbaka 2019. Ett onkolytiskt adenovirus, ett genetiskt modifierat adenovirus vid namn H101, godkändes i Kina 2005 för behandling av huvud-halscancer. [12] Under 2015 blev talimogene laherparepvec (OncoVex, T-VEC), ett onkolytiskt herpesvirus som är en form av modifierad herpes simplex-virus, det första onkolytiska viruset som har godkänts för användning i USA och Europeiska Unionen för behandling av avancerad inoperabel melanom . [13]
Den 16:e december 2022 godkände USAs Food and Drug Administration (FDA) nadofaragene firadenovec-vncg (Adstiladrin, Ferring Pharmaceuticals) för vuxna patienter med högrisk Bacillus Calmette-Guérin (BCG) icke-muskelinvasiv blåscancer (NMIBC) med karcinom in situ (CIS) med eller utan papillära tumörer. [14]
Historia
Ett samband mellan tumörregression och virus har länge spekulerats, och fall rapporter om tumörregression noterad vid livmoderhalscancer, Burkitt lymfom och Hodgkins lymfom, efter infektion eller immunisering med ett icke-relaterat virus började i början av 1900-talet. [15] Ansträngningar för att bekämpa cancer genom immunisering eller viro-terapi (med avsikt infektion med ett virus), började i mitten av 1900-talet. [15] [16] På grund av brister på teknologin för att skapa ett anpassat virus inte fanns, fokuserade alla tidiga ansträngningar på att hitta naturliga onkolytiska virus. Under 1960-talet involverade lovande forskning av användning av poliovirus, [17] adenovirus, [15] Coxsackie-virus, [18] ECHO enterovirus RIGVIR, [19] och andra. [16] Bland enstaka fall hittades komplikationerna som okontrollerad infektion (som resulterade påverkan sjuklighet och mortalitet); ett immunsvar skulle också ofta utvecklas. Även om det inte var direkt skadligt för patienten [15] förstörde svaret viruset och hindrade det från att förstöra cancern. [17] Tidiga ansträngningar visade också att endast vissa cancerformer kunde behandlas genom viroterapi . [18] Även när ett svar sågs var dessa svar varken kompletta eller hållbara. [15] Området viroterapi var nästan övergivet för en tid, eftersom den teknik som krävs för att modifiera virus inte existerade medan kemoterapi och strålbehandlingsteknik hade tidig framgång. Men nu när dessa teknologier har utvecklats grundligt och cancer fortfarande är en viktig orsak till dödlighet, finns det fortfarande ett behov av nya cancerbehandlingar, vilket har väckt denna en gång ställda terapi förnyat intresse. [15] [20]
Herpes simplexvirus
Herpes simplex-virus (HSV) var bland första virusen som utvecklade för att selektivt attackera cancerceller, eftersom det var väl förstått, lätt att modifiera och relativt ofarligt i sitt naturliga delen (som bara orsakar munsår ) så sannolikt att det utgör färre risker. Herpes simplex virus typ 1 (HSV-1) mutant 1716 saknar båda kopiorna av ICP34.5-genen och kan som ett resultat inte längre replikera i terminalt differentierade och icke- delande celler utan kommer att infektera och orsaka lys i cancerceller, och detta har visat sig vara en effektiv strategi för tumörinriktning. [21] [22] I ett stort antal in vivo- cancermodeller har HSV1716 -viruset inducerat tumörregression och ökat överlevnadstider. [23] [24] [25]
Första godkännande i Europa för en klinisk prövning med det onkolytiska viruset HSV1716 skedde under 1996. Från 1997 till 2003 injicerades stam HSV1716 i tumörer hos patienter med glioblastoma multiforme, en mycket malign form av tumör i hjärnan, utan tecken på toxicitet eller biverkningar, och några långtidsöverlevande. [26] [27] [28] Andra form som har genomgått i så kallde säkerhetsfas är HSV1716 för att behandla patienter med melanom och skivepitelcancer i huvud och nacke. [29] [30] Sedan dess har andra studier visat att HSV1716-varianter kan riktas mot specifika typer av cancerceller [31] och kan användas för att leverera en mängd ytterligare gener till cancerceller, såsom gener för att dela en ofarlig prodrug inuti cancerceller för att frigöra toxisk kemoterapi, [32] eller gener som beordrar infekterade cancerceller att koncentrera protein märkt med radioaktivt jod, så att enskilda cancerceller dödas av mikrodosstrålning såväl som av virusinducerad cellys. [33]
Flera onkolytiska virus som är baserade på HSV och som har utvecklats för att utföra kliniska prövningar. [34] En som har godkänts av FDA för avancerat melanom är Amgens talimogene laherparepvec . [35]
Oncorine (H101)
Det första onkolytiska viruset som godkändes med modifierad genom adenovirus vid namn H101 av Shanghai Sunway Biotech. Det fick myndighetsgodkännande 2005 från Kinas statliga livsmedels- och läkemedelsadministration (SFDA) för behandling av huvud-halscancer. [12] [36] Sunways H101 och den mycket liknande Onyx-15 ( dl 1520) har konstruerats för att ta bort en viral försvarsmekanism som interagerar med en normal mänsklig gen p53, som mycket ofta är oreglerad i de flesta cancer och cancerceller . [36] Trots löftena om tidigt labbarbete in vivo, infekterar dessa virus inte specifikt cancerceller, men de dödar fortfarande cancerceller i första hand cancerceller . [36] Medan den totala överlevnaden inte är känd, är korttidssvarsfrekvensen ungefär fördubblad för H101 plus kemoterapi jämfört med enbart kemoterapi. [36] Det verkar fungera bäst när det injiceras direkt i en tumör och när eventuell feber inte dämpas (alltså utan anti-inflammatorisk preparat) . [36] Systemisk terapi (såsom genom infusion genom en intravenös slang) eller intra-tumoralt är önskvärd för behandling av metastaserande sjukdom. [37] Numera marknadsförs läkemedlets under varumärket Oncorine. [38]
Verkningsmekanismer
Immunterapi
Med framsteg inom cancerimmunterapi, såsom immune checkpoint inhibitors, har ökad uppmärksamhet ägnats åt att använda onkolytiska virus för att öka antitumörimmuniteten.
Immunitet som ett hinder
Ett stort hinder för framgången för onkolytiska virus är patientens immunsystem som naturligt försöker inaktivera alla virus. Detta kan vara ett särskilt problem för intravenös injektion, där viruset först måste överleva interaktioner med patienternas immunsystem. [39] Det har visats att immunsuppression genom kemoterapi och hämning av komplementsystemet kan förbättra onkolytisk effekten hos onkolytiska virus. [40] [41] [42] Idag nu så försöker forskarna undvika att ha intravenös som enda sätt att ge behadlingar .
Redan existerande immunitet mot viruset kan delvis undvikas genom att använda virus som inte är vanliga mänskliga patogener eller modifiering. Detta undviker dock inte efterföljande antikroppsgenerering . Ändå har vissa studier visat att preimmunitet mot onkolytiska virus inte orsakar en signifikant minskning av effektiviteten. [43]
Alternativt kan den virala vektorn ändras med en polymer såsom polyetylenglykol, vilket kan skydd viruset från antikroppar, men detta förhindrar också att virushöljeproteiner vidhäftar till värdceller. [44]
Ett annat sätt att hjälpa onkolytiska virus att nå cancertillväxt efter intravenös injektion är att gömma dem inuti makrofager (en typ av immun celler som tillhör vita blodkroppar) . Makrofager migrerar automatiskt till områden med vävnadsförstörelse, särskilt där syre nivåerna är låga, karakteristiska för cancertillväxter, och har framgångsrikt använts för att leverera onkolytiska virus till prostatacancer hos djur. [45]
Immunitet som allierad
Även om det utgör ett hinder genom att inaktivera virus, kan patientens immunsystem också fungera som en allierad mot tumör celler; infektionen runt tumören kan locka patientens immunsystem till tumören och kan bidra till att generera användbar och långvarig antitumörimmunitet. [46] [47] En viktig mekanism är frisättningen av substanser genom tumörlys, såsom tumörassocierade antigener och riskassocierade molekylära mönster (DAMPs), som kan framkalla ett antitumörimmunsvar. [48] Detta producerar i huvudsak ett personligt cancerbehandling.
Många fall remission av cancer har registrerats. Även om orsaken inte är helt klarlagd, tros de sannolikt vara ett resultat av ett plötsligt immunsvar eller infektion. Ansträngningar för att framkalla detta fenomen har använt cancervacciner (som härrör från cancerceller eller utvalda cancerantigener ), eller direkt behandling med immunstimulerande faktorer på hudcancer. Vissa onkolytiska virus är mycket immunogena och kan genom infektion av tumören framkalla ett antitumörimmunsvar, särskilt virus som levererar cytokiner eller andra immunstimulerande faktorer. [49] [50]
Virus infekterar selektivt tumörceller på grund av deras defekta antivirala svar. Imlygic, ett försvagat herpes simplex-virus, har genetiskt modifierats för att replikera företrädesvis inom tumörceller och för att generera antigener som framkallar ett immunsvar.
Onkolytiskt beteende hos vildtypsvirus
Vacciniavirus
Vacciniavirus (VACV) är bland de mest framgångsrika levande bioterapeutiska medlet på grund av dess avgörande roll i utrotningen av smittkoppor, en av de mest dödliga sjukdomarna i mänsklighetens historia. Långt innan kampanjen för utrotning av smittkoppor lanserades, utnyttjades VACV som ett terapeutiskt medel för behandling av cancer. 1922 rapporterade Levaditi och Nicolau att VACV kunde hämma tillväxten av olika tumörer hos möss och råttor. Detta var den första demonstrationen av viral onkolytiska studien i laboratoriet. viruset visade sig sedan selektivt infektera och förstöra tumörceller, samtidigt som det skonade normala celler, både i cellkulturer och i djurmodeller. Eftersom vacciniavirus länge har erkänts som en idealisk ryggrad för vacciner på grund av dess potenta antigenpresentationsförmåga, kombineras detta väl med dess naturliga onkolytiska aktiviteter som ett onkolytiskt virus för cancerimmunterapi . [51]
Vesikulär stomatitvirus
Vesikulärt stomatitvirus (VSV) är ett rhabdovirus som består av 5 gener som kodas av ett negativt sens, enkelsträngat RNA-genom. I naturen VSV kan infektera bland annat insekter, boskap, där det orsakar en relativt lokal och icke-dödlig sjukdom. Den låga patogeniciteten hos detta virus beror till stor del på dess känslighet mot interferoner, en klass av proteiner som släpps ut i vävnaderna och blodomloppet under infektion. Dessa molekyler i sin tur aktiverar genetiska antivirala försvarsmekanism som skyddar cellerna från infektion och förhindrar spridning av virus partiklar. Men 2000-talet, Stojdl, Lichty et al. [52] visade att defekter i dessa mekanismer gör att cancerceller inte svarar på de skyddande effekterna av interferoner och därför är mycket känsliga för infektion med VSV. Eftersom VSV genomgår en snabb cytolytiska replikationscykel, leder infektion till döden av den maligna cancer cellen och ungefär1000-faldig amplifiering av virus på 24 timmar. VSV är därför känns lämplig för terapeutisk tillämpning, och flera grupper har fortsatt med att visa att systemiskt administrerad VSV kan levereras till ett område där tumören är, där det replikerar, vilket ofta leder till varaktiga botemedel. [53] [54] [55] [56] Attenuering av viruset genom att konstruera en modifierin av Met-51 av matrix proteinet tar bort praktiskt taget all infektion av normala celler , medan replikationen i tumör celler är opåverkad. [53]
Det finns nya forskning som har visat att dessa virus har bra potential effekt hjärntumörer, tack vare dess onkolytiska kapacitet. [57]
Poliovirus
Poliovirus är ett naturligt invasivt neurotropiskt virus, vilket gör det till det självklara valet för selektiv replikation i tumörer med neuronala celler ursprung. Poliovirus är ett plussträngat RNA-virus, vars translation beror på ett vävnadsspecifikt internt ribosominträdesställe (IRES) inom den 5'-otranslaterade regionen av det virala genen, som är aktivt i celler med neuronalt ursprung och tillåter translation av viralt genom utan 5'-lock. Gromeier et al. (2000) [58] ersatte det normala poliovirus IRES med ett rhinovirus IRES, vilket förändrade vävnadsspecificiteten. Det resulterande PV1(RIPO) -viruset kunde selektivt förstöra maligna gliomceller, samtidigt som de lämnade normala neuronala celler orörda. [59]
Reovirus
Reovirus infekterar i allmänhet andningsvägar och tarmsystem hos däggdjur. De flesta människor har exponerats för reovirus i vuxen ålder; infektionen ger dock vanligtvis inga symtom. Reovirusets onkolytiska potential etablerades efter att de upptäcktes att reproducera sig bra i olika cancercellinjer, vilket lyserar dessa celler. [60]
Reolysin är en formulering av reovirus avsedd att behandla olika cancerformer som för närvarande genomgår i olika kliniska prövningar. [61]
Senecavirus
Senecavirus, även känt som Seneca Valley Virus, är ett naturligt förekommande onkolytiskt picornavirus av vildtyp som upptäcktes år 2001 som en vävnadskulturkontaminering vid Genetic Therapy, Inc. Det initiala isolatet, SVV-001, utvecklas som ett behandlingsmedel mot cancer av Neotropix, Inc. under namnet NTX-010 för cancer med neuroendokrina ursprung och småcellig lungcancer och en mängd olika pediatriska solida tumörer.
RIGVIR
RIGVIR är ett läkemedel som godkändes av den läkemedelsmyndigheten i Republiken Lettland 2004. [62] Det godkändes även Georgien [63] och Armenien . [64] Det är vildtyp ECHO-7, en medlem av ekovirusgruppen . [65] Den potentiella användningen av ekovirus som ett onkolytiskt virus för att behandla cancer upptäcktes av den lettiska forskaren Aina Muceniece på 1960- och 1970-talen. [65] Uppgifterna för att få läkemedlet godkännande att använda det i USA, Europa eller Japan är inte tillräckliga för att erhålla. [65] [66]2017 bestämde man att det finns inte bra bevis för att räkna RIGVIR som ett effektiv cancerbehandling . [67] [68] Den 19 mars 2019 meddelade tillverkaren av ECHO-7, SIA LATIMA, att läkemedlet tas bort från marknaden i Lettland, med angivande av ekonomiska skäl och otillräcklig lönsamhet. [69] Men flera dagar senare avslöjade ett undersökande TV-program att Statens läkemedelsmyndighet hade utfört laboratorietester på rören och kom from att mängden ECHO-7-virus var betydligt mindre än vad forskaren hävdar. Enligt myndighetens labbchef, "det är som att köpa vad du tror är citronsaft, men att upptäcka att det du har är vatten med citronsmak". I mars 2019 stoppades användning av ECHO-7 i Lettland. [70] På begäran av vissa patienter tilläts medicinska institutioner och läkare att fortsätta använda trots upphävandet av registreringsbeviset. [71]
Semliki Forest virus
Semliki Forest virus (SFV) är ett virus som naturligt infekterar celler i det centrala nervsystemet och orsakar encefalit . En genetiskt modifierad form av SFV har prekliniskt testats som ett onkolytiskt virus mot den svåra hjärntumören glioblastom . SFV:n modifierades genetiskt med mikroRNA- så att den endast replikera sig i hjärntumörceller och inte i normala hjärnceller. Det modifierade viruset minskade tumörtillväxt och förlängde överlevnaden för möss med hjärntumörer. [72] Det modifierade viruset visade sig också effektivt döda humana glioblastom tumörcellinjer. [72]
Övrig
Marabaviruset, som först identifierades i brasilianska sandflugor, testas kliniskt.
Coxsackievirus A21 utvecklas av Viralytics under varumärket Cavatak. [73] Coxsackievirus A21 tillhör Enterovirus C -arter. [74]
Influensa A är ett av de tidigaste virus som rapporterats inducera tumörregression. [75] Detta har lett till preklinisk utveckling av genetiskt modifierade onkolytiska influensa A-virus. [76] Murint respirovirus, som ofta kallas Sendai-virus i vetenskaplig litteratur, har visat vissa onkolytiska egenskaper som beskrivs i avsnittet Murint respirovirus som ett onkolytiskt medel .
Engineering onkolytiska virus
Riktad evolution
Ett innovativt tillvägagångssätt för läkemedelsutveckling som kallas " riktad evolution " involverar skapandet av nya virala varianter eller serotyper specifikt riktade mot tumörceller via rundor av riktat urval med användning av stora populationer av slumpmässigt genererade rekombinanta prekursorvirus. Den ökade biologiska mångfalden som produceras av det initiala homologa rekombinationssteget ger en stor slumpmässig pool av viruskandidater som sedan kan passeras genom en serie urvalssteg utformade för att leda mot ett förbestämt resultat (t.ex. högre tumörspecifik aktivitet) utan att det krävs några förkunskaper. av de resulterande virala mekanismerna som är ansvariga för det resultatet. Poolen av resulterande onkolytiska virus kan sedan screenas ytterligare i prekliniska modeller för att välja ett onkolytiskt virus med de önskade terapeutiska egenskaperna. [77]
Riktad evolution applicerades på humant adenovirus, ett av många virus som utvecklas som onkolytiska medel, för att skapa ett mycket selektivt och ändå potent onkolytiskt vaccin. Som ett resultat av denna process genererades ColoAd1 (en ny chimär medlem av grupp B-adenovirus). Denna hybrid av adenovirus serotyper Ad11p och Ad3 visar mycket högre potens och tumörselektivitet än kontrollvirusen (inklusive Ad5, Ad11p och Ad3) och bekräftades generera ungefär två loggar mer viral avkomma på nyligen isolerad human kolontumörvävnad än på matchande normal vävnad . [77]
Försvagning
Attenuering innebär radering av virala gener, eller genregioner, för att eliminera virala funktioner som är förbrukbara i tumörceller, men inte i normala celler, vilket gör viruset säkrare och mer tumörspecifikt. Cancerceller och virusinfekterade celler har liknande förändringar i sina cellsignaleringsvägar, särskilt de som styr utvecklingen genom cellcykeln . [78] En viral gen vars funktion är att förändra en väg är dispenserbar i celler där vägen är defekt, men inte i celler där vägen är aktiv. </link>[ <span title="This claim needs references to reliable sources. (February 2023)">citat behövs</span> ]
Enzymerna tymidinkinas och ribonukleotidreduktas i celler är ansvariga för DNA-syntes och uttrycks endast i celler som aktivt replikerar. [79] Dessa enzymer finns också i genomen av vissa virus (t.ex. HSV, vaccinia) och tillåter viral replikation i vilande (icke-replikerande) celler [80] så om de inaktiveras av mutation kommer viruset bara att kunna replikera i prolifererande celler såsom cancerceller.
Det finns två huvudsakliga tillvägagångssätt för att generera tumörselektivitet: transduktionell och icke-transduktionell inriktning. [81]
- Transduktionell inriktning involverar modifiering av virushöljesproteinerna för att rikta in sig på tumörceller samtidigt som inträdet till icke-tumörceller reduceras. Detta tillvägagångssätt för tumörselektivitet har huvudsakligen fokuserat på adenovirus och HSV-1, även om det är helt genomförbart med andra virus. [81]
- Icke-transduktionell inriktning innebär att virusets genom förändras så att det bara kan replikera i cancerceller, oftast som en del av virusets försvagning. [81]
- Transkriptionsinriktning kan också användas, där kritiska delar av det virala genomet placeras under kontroll av en tumörspecifik promotor . En lämplig promotor bör vara aktiv i tumören men inaktiv i majoriteten av normal vävnad, särskilt levern, som är det organ som är mest exponerat för blodfödda virus. Många sådana promotorer har identifierats och studerats för behandling av en rad cancerformer. [81]
- På liknande sätt kan viral replikation finjusteras med användning av mikroRNA (miRNA) artificiella målställen eller miRNA-responselement (MRE). Differentiellt uttryck av miRNA mellan friska vävnader och tumörer gör det möjligt att konstruera onkolytiska virus som avlägsnas från vissa vävnader av intresse samtidigt som de tillåter replikering i tumörcellerna. </link>[ <span title="This claim needs references to reliable sources. (February 2023)">citat behövs</span> ]
Dubbel inriktning med både transduktions- och icke-transduktionsorienteringsmetoder är effektivare än någon form av inriktning ensam. [82]
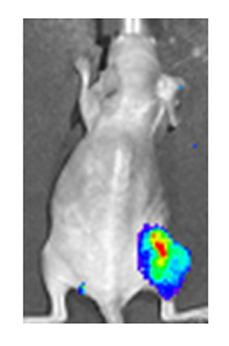
Både i laboratoriet och på kliniken är det användbart att ha ett enkelt sätt att identifiera celler infekterade av det experimentella viruset. Detta kan göras genom att utrusta viruset med " reportergener " som normalt inte finns i virala genom, som kodar för lätt identifierbara proteinmarkörer. Ett exempel på sådana proteiner är GFP ( grönt fluorescerande protein ) som, när det finns i infekterade celler, kommer att orsaka att ett fluorescerande grönt ljus sänds ut när det stimuleras av blått ljus. [83] [84] En fördel med denna metod är att den kan användas på levande celler och hos patienter med ytliga infekterade lesioner, den möjliggör snabb icke-invasiv bekräftelse av virusinfektion. [85] Ett annat exempel på en visuell markör användbar i levande celler är luciferas, ett enzym från eldflugan som i närvaro av luciferin avger ljus som kan detekteras av specialiserade kameror. [83]

E. coli- enzymerna beta-glukuronidas och beta-galaktosidas kan också kodas av vissa virus. Dessa enzymer, i närvaro av vissa substrat, kan producera intensivt färgade föreningar användbara för att visualisera infekterade celler och även för att kvantifiera genuttryck. </link>[ <span title="This claim needs references to reliable sources. (February 2023)">citat behövs</span> ]
Onkolytiska virus kan användas mot cancer på sätt som är utöver lysering av infekterade celler.
Virus kan användas som vektorer för leverans av självmordsgener, kodande för enzymer som kan metabolisera en separat administrerad icke-toxisk prodrug till ett potent cytotoxin, som kan diffundera till och döda närliggande celler. Ett herpes simplex-virus, som kodar för en tymidinkinas-självmordsgen, har gått vidare till kliniska fas III-prövningar. Herpes simplex-viruset tymidinkinas fosforylerar proläkemedlet ganciklovir, som sedan inkorporeras i DNA, vilket blockerar DNA-syntesen. [86] Tumörselektiviteten hos onkolytiska virus säkerställer att självmordsgenerna endast uttrycks i cancerceller, dock har en "åskådareffekt" på omgivande tumörceller beskrivits med flera självmordsgensystem. [87]
Undertryckande av angiogenes
Angiogenes (bildning av blodkärl) är en väsentlig del av bildandet av stora tumörmassor. Angiogenes kan hämmas genom uttryck av flera gener, som kan levereras till cancerceller i virala vektorer, vilket resulterar i undertryckande av angiogenes och syresvält i tumören. Infektionen av celler med virus som innehåller generna för angiostatin- och endostatinsyntes hämmade tumörtillväxt hos möss. Förbättrade antitumöraktiviteter har visats i ett rekombinant vacciniavirus som kodar för anti-angiogen terapeutisk antikropp och med en HSV1716-variant som uttrycker en hämmare av angiogenes. [88] [89]
Radiojod

Tillägg av natriumjodid symporter- genen (NIS) till det virala genomet får infekterade tumörceller att uttrycka NIS och ackumulera jod. I kombination med radiojodbehandling möjliggör den lokal strålbehandling av tumören, som används för att behandla sköldkörtelcancer. Radiojoden kan också användas för att visualisera viral replikation i kroppen genom att använda en gammakamera . [83] Detta tillvägagångssätt har använts framgångsrikt prekliniskt med adenovirus, mässlingvirus och vacciniavirus. [90] [91] [92]
Godkända terapeutiska medel
- Talimogene laherparepvec ( OncoVEX GM-CSF ), alias T-vec, av Amgen, genomförde framgångsrikt fas III-studier för avancerat melanom i mars 2013. I oktober 2015 godkände amerikanska FDA T-VEC, med varumärket Imlygic, för behandling av melanom hos patienter med inoperabla tumörer. [93] att bli det första godkända onkolytiska medlet i västvärlden. [94] Den är baserad på herpes simplex-virus (HSV-1). Det har också testats i en fas I-studie för cancer i bukspottkörteln och en fas III-studie i huvud- och halscancer tillsammans med cisplatin- kemoterapi och strålbehandling.
- Teserpaturev (G47∆), aka Delytact av Daiichi Sankyo är en första onkolytisk virusterapi som godkänts av det japanska ministeriet för hälsa, arbetsmarknad och välfärd (MHLW). Delytact är ett genetiskt modifierat onkolytiskt herpes simplex-virus typ 1 (HSV-1) godkänt för behandling av malignt gliom i Japan.
Onkolytiska virus i samband med existerande cancerterapier
Det är i samband med konventionella cancerterapier som onkolytiska virus ofta har visat sig mest lovande, eftersom kombinerade terapier fungerar synergistiskt utan några uppenbara negativa effekter. [95]
Kliniska tester
Onyx-015 ( <i id="mwAhc">dl</i> 1520) genomgick försök i samband med kemoterapi innan det övergavs i början av 2000-talet. Den kombinerade behandlingen gav ett större svar än endera behandlingen, men resultaten var inte helt avgörande. [96] Vacciniavirus GL-ONC1 studerades i en studie kombinerad med kemo- och strålbehandling som standardvård för patienter som nyligen diagnostiserats med huvud- och halscancer. [97] Herpes simplex-virus, adenovirus, reovirus och murint leukemivirus genomgår också kliniska prövningar som en del av kombinationsterapier. [98]
Preklinisk forskning
Chen et al. (2001) [99] använde CV706, ett prostataspecifikt adenovirus, i samband med strålbehandling av prostatacancer hos möss. Den kombinerade behandlingen resulterade i en synergistisk ökning av celldöd, såväl som en signifikant ökning av virussprängningsstorleken (antalet viruspartiklar som frigjordes från varje cellys). Ingen förändring i viral specificitet observerades. </link>[ <span title="This claim needs references to reliable sources. (February 2023)">citat behövs</span> ]
SEPREHVIR (HSV-1716) har också visat synergi inom preklinisk forskning när det används i kombination med flera cancerkemoterapier. [100] [101]
Anti- angiogenesläkemedlet bevacizumab (anti- VEGF -antikropp) har visat sig minska det inflammatoriska svaret på onkolytiskt HSV och förbättra viroterapi hos möss. [102] Ett modifierat onkolytiskt vacciniavirus som kodar för en enkelkedjig anti-VEGF-antikropp (som härmar bevacizumab) visades ha signifikant förbättrad antitumöraktivitet än föräldravirus i djurmodeller. [103]
I fiktion
Inom science fiction introducerades begreppet onkolytiskt virus först för allmänheten i Jack Williamsons roman Dragon's Island, publicerad 1951, även om Williamsons imaginära virus var baserat på en bakteriofag snarare än ett däggdjursvirus. Dragon's Island är också känd för att vara källan till termen " genteknik" . [104]
Handlingen i Hollywood-filmen I Am Legend är baserad på premissen att en världsomspännande epidemi orsakades av ett viralt botemedel mot cancer. [105]
- ^ Systemic delivery of oncolytic viruses: hopes and hurdles.
- ^ Desk Encyclopedia of General Virology.
- ^ Thunder and lightning: immunotherapy and oncolytic viruses collide. June 2011.
- ^ Going viral with cancer immunotherapy. August 2014.
- ^ (på engelska) Double trouble for tumours: Exploiting the tumour microenvironment to enhance anticancer effect of oncolytic viruses. 2010-04-01. https://www.sciencedirect.com/science/article/pii/S1359610110000183.
- ^ ”Using Viruses to Treat Cancer | Science-Based Medicine” (på amerikansk engelska). sciencebasedmedicine.org. 2022-09-28. https://sciencebasedmedicine.org/using-viruses-to-treat-cancer/.
- ^ Viruses in cancer treatment. March 2013.
- ^ Recent clinical experience with oncolytic viruses. July 2012.
- ^ Naturally oncolytic viruses. August 2006.
- ^ Phase I clinical study of Seneca Valley Virus (SVV-001), a replication-competent picornavirus, in advanced solid tumors with neuroendocrine features. February 2011.
- ^ ”Rigvir šķīdums injekcijām”. Medicinal product register of the Republic of Latvia. 2004-04-29. https://www.zva.gov.lv/zvais/zalu-registrs/?iss=1&lang=en&q=Rigvir&ON=&SN=&.
- ^ [a b] Chinese health biotech and the billion-patient market. January 2008. Referensfel: Taggen
<ref>är ogiltig; namnet "pmid18183014" definieras flera gånger med olika innehåll - ^ ”FDA Panels Support Approval of T-VEC in Melanoma”. FDA Panels Support Approval of T-VEC in Melanoma. 29 April 2015. https://www.onclive.com/web-exclusives/FDA-Panels-Support-Approval-of-T-VEC-in-Melanoma.
- ^ Research, Center for Drug Evaluation and (2022-12-29). ”FDA approves first adenoviral vector-based gene therapy for high-risk Bacillus Calmette-Guérin unresponsive non-muscle invasive bladder cancer” (på engelska). FDA. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-first-adenoviral-vector-based-gene-therapy-high-risk-bacillus-calmette-guerin.
- ^ [a b c d e f] ”Viral oncolysis by herpes simplex virus and other viruses”. Cancer Biology & Therapy 4 (5): sid. 524–31. May 2005. doi:. PMID 15917655.
- ^ [a b] ”Potential use of nonpathogenic enteroviruses for control of human disease”. Progress in Medical Virology. Fortschritte der Medizinischen Virusforschung. Progrès en Virologie Médicale 36: sid. 191–202. PMID 2555836.
- ^ [a b] ”Oncolytic Effect of Poliomyelitis Virus on Human Epidermoid Carcinoma (Hela Tumor) Heterologously Transplanted to Guinea Pigs”. The American Journal of Pathology 45 (2): sid. 233–49. August 1964. PMID 14202523.
- ^ [a b] ”Cellular Susceptibility to Enteroviruses”. Bacteriological Reviews 28 (4): sid. 382–90. December 1964. doi:. PMID 14244713.
- ^ ”[Oncolytic enteroviruses]”. Molekuliarnaia Biologiia 46 (5): sid. 712–25. 2012. doi:. PMID 23156670.
- ^ ”History of oncolytic viruses: genesis to genetic engineering”. Molecular Therapy 15 (4): sid. 651–9. April 2007. doi:. PMID 17299401.
- ^ ”Herpes simplex virus type 1 deletion variants 1714 and 1716 pinpoint neurovirulence-related sequences in Glasgow strain 17+ between immediate early gene 1 and the 'a' sequence”. The Journal of General Virology 72 ( Pt 3) (3): sid. 631–9. March 1991. doi:. PMID 1848598.
- ^ ”Cell type and cell state determine differential in vitro growth of non-neurovirulent ICP34.5-negative herpes simplex virus types 1 and 2”. The Journal of General Virology 75 ( Pt 9) (9): sid. 2367–77. September 1994. doi:. PMID 8077935.
- ^ ”Therapy of experimental human brain tumors using a neuroattenuated herpes simplex virus mutant”. Laboratory Investigation; A Journal of Technical Methods and Pathology 73 (5): sid. 636–48. November 1995. PMID 7474937.
- ^ ”Selective in vitro replication of herpes simplex virus type 1 (HSV-1) ICP34.5 null mutants in primary human CNS tumours--evaluation of a potentially effective clinical therapy”. British Journal of Cancer 74 (5): sid. 745–52. September 1996. doi:. PMID 8795577.
- ^ ”Treatment of experimental subcutaneous human melanoma with a replication-restricted herpes simplex virus mutant”. The Journal of Investigative Dermatology 108 (6): sid. 933–7. June 1997. doi:. PMID 9182825.
- ^ ”Toxicity evaluation of replication-competent herpes simplex virus (ICP 34.5 null mutant 1716) in patients with recurrent malignant glioma”. Gene Therapy 7 (10): sid. 859–66. May 2000. doi:. PMID 10845724.
- ^ ”The potential for efficacy of the modified (ICP 34.5(-)) herpes simplex virus HSV1716 following intratumoural injection into human malignant glioma: a proof of principle study”. Gene Therapy 9 (6): sid. 398–406. March 2002. doi:. PMID 11960316.
- ^ ”HSV1716 injection into the brain adjacent to tumour following surgical resection of high-grade glioma: safety data and long-term survival”. Gene Therapy 11 (22): sid. 1648–58. November 2004. doi:. PMID 15334111.
- ^ ”Intralesional injection of herpes simplex virus 1716 in metastatic melanoma”. Lancet 357 (9255): sid. 525–6. February 2001. doi:. PMID 11229673.
- ^ ”Potential for efficacy of the oncolytic Herpes simplex virus 1716 in patients with oral squamous cell carcinoma”. Head & Neck 30 (8): sid. 1045–51. August 2008. doi:. PMID 18615711.
- ^ ”A strategy for systemic delivery of the oncolytic herpes virus HSV1716: redirected tropism by antibody-binding sites incorporated on the virion surface as a glycoprotein D fusion protein”. Gene Therapy 15 (24): sid. 1579–92. December 2008. doi:. PMID 18701918.
- ^ ”Antitumor activity of a selectively replication competent herpes simplex virus (HSV) with enzyme prodrug therapy”. Anticancer Research 29 (6): sid. 2159–66. June 2009. PMID 19528476.
- ^ ”In vivo evaluation of a cancer therapy strategy combining HSV1716-mediated oncolysis with gene transfer and targeted radiotherapy”. Journal of Nuclear Medicine 53 (4): sid. 647–54. April 2012. doi:. PMID 22414636.
- ^ ”Evidence for Oncolytic Virotherapy: Where Have We Got to and Where Are We Going?”. Viruses 7 (12): sid. 6291–312. December 2015. doi:. PMID 26633468.
- ^ ”Talimogene laherparepvec: First in class oncolytic virotherapy”. Human Vaccines & Immunotherapeutics 14 (4): sid. 839–846. February 2018. doi:. PMID 29420123.
- ^ [a b c d e] ”China approves world's first oncolytic virus therapy for cancer treatment”. Journal of the National Cancer Institute 98 (5): sid. 298–300. March 2006. doi:. PMID 16507823.
- ^ ”Gene therapy in the management of oral cancer: review of the literature”. Medicina Oral, Patologia Oral y Cirugia Bucal 13 (1): sid. E15–21. January 2008. PMID 18167474.
- ^ ”Chinese gene therapy. Splicing out the West?”. Science 314 (5803): sid. 1232–5. November 2006. doi:. PMID 17124300.
- ^ ”Awaiting a moment of truth for oncolytic viruses”. Journal of the National Cancer Institute 105 (10): sid. 675–6. May 2013. doi:. PMID 23650626.
- ^ ”Improved systemic delivery of oncolytic reovirus to established tumors using preconditioning with cyclophosphamide-mediated Treg modulation and interleukin-2”. Clinical Cancer Research 15 (2): sid. 561–9. January 2009. doi:. PMID 19147761.
- ^ ”A phase I study of the combination of intravenous reovirus type 3 Dearing and gemcitabine in patients with advanced cancer”. Clinical Cancer Research 17 (3): sid. 581–8. February 2011. doi:. PMID 21106728.
- ^ ”Inhibitors of C5 complement enhance vaccinia virus oncolysis”. Cancer Gene Therapy 20 (6): sid. 342–50. June 2013. doi:. PMID 23661042.
- ^ ”Randomized dose-finding clinical trial of oncolytic immunotherapeutic vaccinia JX-594 in liver cancer”. Nature Medicine 19 (3): sid. 329–36. March 2013. doi:. PMID 23396206.
- ^ ”PEGylated Adenoviruses: From Mice to Monkeys”. Viruses 2 (2): sid. 468–502. February 2010. doi:. PMID 21994645.
- ^ ”Macrophage delivery of an oncolytic virus abolishes tumor regrowth and metastasis after chemotherapy or irradiation”. Cancer Research 73 (2): sid. 490–495. 2013-01-15. doi:. PMID 23172310.
- ^ ”Oncolytic viruses for induction of anti-tumor immunity”. Current Pharmaceutical Biotechnology 13 (9): sid. 1750–60. July 2012. doi:. PMID 21740355.
- ^ ”Immune recruitment and therapeutic synergy: keys to optimizing oncolytic viral therapy?”. Clinical Cancer Research 17 (13): sid. 4214–24. July 2011. doi:. PMID 21576084.
- ^ ”Oncolytic viruses—immunotherapeutics on the rise”. Journal of Molecular Medicine 94 (9): sid. 979–991. 2016-09-01. doi:. PMID 27492706.
- ^ ”Virotherapy clinical trials for regional disease: in situ immune modulation using recombinant poxvirus vectors”. Cancer Gene Therapy 9 (12): sid. 1013–21. December 2002. doi:. PMID 12522440.
- ^ ”New frontiers in oncolytic viruses: optimizing and selecting for virus strains with improved efficacy”. Biologics: Targets and Therapy 12: sid. 43–60. 2018. doi:. PMID 29445265.
- ^ ”Oncolytic Viruses in cancer therapy”. Oncolytic Viruses in cancer therapy. https://ibiotherapy.com/all-immunotherapy/oncolytic-viruses/. Läst 11 april 2023.
- ^ ”Exploiting tumor-specific defects in the interferon pathway with a previously unknown oncolytic virus”. Nature Medicine 6 (7): sid. 821–5. July 2000. doi:. PMID 10888934.
- ^ [a b] ”VSV strains with defects in their ability to shutdown innate immunity are potent systemic anti-cancer agents”. Cancer Cell 4 (4): sid. 263–75. October 2003. doi:. PMID 14585354.
- ^ ”Sensitivity of prostate tumors to wild type and M protein mutant vesicular stomatitis viruses”. Virology 330 (1): sid. 34–49. December 2004. doi:. PMID 15527832.
- ^ ”Systemic therapy of experimental breast cancer metastases by mutant vesicular stomatitis virus in immune-competent mice”. Cancer Gene Therapy 12 (4): sid. 350–8. April 2005. doi:. PMID 15565179.
- ^ ”The oncolytic effect of recombinant vesicular stomatitis virus is enhanced by expression of the fusion cytosine deaminase/uracil phosphoribosyltransferase suicide gene”. Cancer Research 63 (23): sid. 8366–76. December 2003. PMID 14678998.
- ^ ”Potentiating cancer immunotherapy using an oncolytic virus”. Molecular Therapy 18 (8): sid. 1430–9. August 2010. doi:. PMID 20551919.
- ^ ”Intergeneric poliovirus recombinants for the treatment of malignant glioma”. Proceedings of the National Academy of Sciences of the United States of America 97 (12): sid. 6803–8. June 2000. doi:. PMID 10841575.
- ^ ”Preparing an oncolytic poliovirus recombinant for clinical application against glioblastoma multiforme”. Cytokine & Growth Factor Reviews 21 (2–3): sid. 197–203. doi:. PMID 20299272.
- ^ ”Reovirus: Rationale and clinical trial update”. Current Opinion in Molecular Therapeutics 11 (5): sid. 532–9. October 2009. PMID 19806501.
- ^ ”Oncolytic Viral Therapy Using Reovirus”. Gene Therapy of Cancer. Methods in Molecular Biology. "542". 2009. Sid. 607–34. doi:. ISBN 978-1-934115-85-5.
- ^ ”Fel: |url= måste specificeras vid användandet av
{{cite web}}”. Latvijas Zāļu reģistrs. - ^ ”Fel: |url= måste specificeras vid användandet av
{{cite web}}”. Georgia Today. - ^ ”Fel: |url= måste specificeras vid användandet av
{{cite web}}”. Latvian Rigvir anti-cancer medicine registered in Armenia. 11 May 2016. - ^ [a b c] ”Oncolytic virotherapy including Rigvir and standard therapies in malignant melanoma.”. Oncolytic Virotherapy 6: sid. 11–18. 2017. doi:. PMID 28224120.
- ^ ”Fel: |url= måste specificeras vid användandet av
{{cite web}}”. Feasibility study for registration of medicine RIGVIR with the European Medicine Agency. 2016-01-08. - ^ ”Fel: |url= måste specificeras vid användandet av
{{cite web}}”. Rigvir: Another unproven and dubious cancer therapy to be avoided. 18 September 2017. - ^ . https://sciencebasedmedicine.org/the-truth-about-cancer-and-the-unethical-marketing-of-the-unproven-cancer-cure-rigvir/.
- ^ ”Fel: |url= måste specificeras vid användandet av
{{cite web}}”. Rigvir medication distribution in Latvia halted temporarily. 19 March 2019. - ^ ”Fel: |url= måste specificeras vid användandet av
{{cite web}}”. Rigvir cancer treatment at center of fresh controversy. - ^ ”Fel: |url= måste specificeras vid användandet av
{{cite web}}”. Apturēta Rigvir reģistrācija; informācija esošajiem pacientiem | Zāļu valsts aģentūra. - ^ [a b] . March 2017.
- ^ Viral targeting of non-muscle invasive bladder cancer and priming of anti-tumour immunity following intravesical Coxsackievirus A21. "25". 2019. sid. 5818–5831. doi:. PMID 31273010.
- ^ Newly Identified Enterovirus C Genotypes, Identified in the Netherlands through Routine Sequencing of All Enteroviruses Detected in Clinical Materials from 2008 to 2015. "54". 2016. sid. 2306–2314. doi:. PMID 27358467.
- ^ Dock, George. ”The influence of complicating diseases upon leukaemia.”. The American Journal of the Medical Sciences (1827-1924); Philadelphia 127 (4). https://scholar.google.com/scholar_lookup?journal=Am.+J.+Med.+Sci.&title=The+influence+of+complicating+diseases+upon+leukaemia&author=G+Dock&volume=127&publication_year=1904&pages=563&.
- ^ Kabiljo, Julijan. ”From threat to cure: understanding of virus-induced cell death leads to highly immunogenic oncolytic influenza viruses”. Cell Death Discovery 6.
- ^ [a b] ”Directed evolution generates a novel oncolytic virus for the treatment of colon cancer”. PLOS ONE 3 (6): sid. e2409. June 2008. doi:. PMID 18560559. Bibcode: 2008PLoSO...3.2409K. Referensfel: Taggen
<ref>är ogiltig; namnet "Kuhn I, Harden P, Bauzon M, Chartier C, Nye J, Thorne S, Reid T, Ni S, Lieber A, Fisher K, Seymour L, Rubanyi GM, Harkins RN, Hermiston TW 2008 e2409" definieras flera gånger med olika innehåll - ^ ”Cell Cycle Control by Oncogenes and Tumor Suppressors: Driving the Transformation of Normal Cells into Cancerous Cells”. Nature Education 3 (9): sid. 7.
- ^ ”Thymidine kinase”. Medical Dictionary. Merriam-Webster. https://www.merriam-webster.com/medical/thymidine%20kinase.
- ^ Viral thymidine kinases and their relatives.
- ^ [a b c d] ”Oncolytic viruses & their specific targeting to tumour cells”. The Indian Journal of Medical Research 136 (4): sid. 571–84. October 2012. PMID 23168697. Referensfel: Taggen
<ref>är ogiltig; namnet "Singh_2012" definieras flera gånger med olika innehåll - ^ ”Infectivity-enhanced cyclooxygenase-2-based conditionally replicative adenoviruses for esophageal adenocarcinoma treatment”. Cancer Research 64 (12): sid. 4319–27. June 2004. doi:. PMID 15205347.
- ^ [a b c] ”Imaging characteristics, tissue distribution, and spread of a novel oncolytic vaccinia virus carrying the human sodium iodide symporter”. PLOS ONE 7 (8): sid. e41647. doi:. PMID 22912675. Bibcode: 2012PLoSO...741647H. Referensfel: Taggen
<ref>är ogiltig; namnet "Haddad 2012 e41647" definieras flera gånger med olika innehåll - ^ ”Characterization of a full-length infectious cDNA clone and a GFP reporter derivative of the oncolytic picornavirus SVV-001”. The Journal of General Virology 93 (Pt 12): sid. 2606–13. December 2012. doi:. PMID 22971818.
- ^ ”Visualization of tumors and metastases in live animals with bacteria and vaccinia virus encoding light-emitting proteins”. Nature Biotechnology 22 (3): sid. 313–20. March 2004. doi:. PMID 14990953.
- ^ In situ use of suicide genes for cancer therapy.
- ^ Suicide gene therapy in cancer: where do we stand now?.
- ^ ”Anti-VEGF single-chain antibody GLAF-1 encoded by oncolytic vaccinia virus significantly enhances antitumor therapy”. Proceedings of the National Academy of Sciences of the United States of America 106 (31): sid. 12915–20. August 2009. doi:. PMID 19617539. Bibcode: 2009PNAS..10612915F.
- ^ ”Expression of inhibitor of growth 4 by HSV1716 improves oncolytic potency and enhances efficacy”. Cancer Gene Therapy 19 (7): sid. 499–507. July 2012. doi:. PMID 22595793.
- ^ ”Sodium iodide symporter (NIS)-mediated radiovirotherapy of hepatocellular cancer using a conditionally replicating adenovirus”. Gene Therapy 20 (6): sid. 625–33. June 2013. PMID 23038026.
- ^ ”Sodium iodide symporter (NIS)-mediated radiovirotherapy for pancreatic cancer”. AJR. American Journal of Roentgenology 195 (2): sid. 341–9. August 2010. PMID 20651188.
- ^ ”Oncolytic measles viruses encoding interferon beta and the thyroidal sodium iodide symporter gene for mesothelioma virotherapy”. Cancer Gene Therapy 17 (8): sid. 550–8. August 2010. PMID 20379224.
- ^ ”Fel: |url= måste specificeras vid användandet av
{{cite web}}”. 27 October 2015. - ^ . June 2015.
- ^ ”Intelligent design: combination therapy with oncolytic viruses”. Molecular Therapy 18 (2): sid. 251–63. February 2010. doi:. PMID 20029399.
- ^ . August 2000.
- ^ . October 2017.
- ^ . March 2017.
- ^ ”CV706, a prostate cancer-specific adenovirus variant, in combination with radiotherapy produces synergistic antitumor efficacy without increasing toxicity”. Cancer Research 61 (14): sid. 5453–60. July 2001. PMID 11454691.
- ^ ”Cytotoxic effects of the oncolytic herpes simplex virus HSV1716 alone and in combination with cisplatin in head and neck squamous cell carcinoma”. Acta Oto-Laryngologica 127 (8): sid. 880–7. August 2007. doi:. PMID 17763002.
- ^ ”Combined therapy with chemotherapeutic agents and herpes simplex virus type 1 ICP34.5 mutant (HSV-1716) in human non-small cell lung cancer”. Human Gene Therapy 10 (18): sid. 3013–29. December 1999. doi:. PMID 10609661.
- ^ . May 2013.
- ^ . August 2009.
- ^ Historical dictionary of science fiction literature. Scarecrow Press. https://books.google.com/books?id=nzmIPZg5xicC&q=Jack+Williamson+Dragon%27s+Island+genetic+engineering&pg=PR9.
- ^ ”Fel: |url= måste specificeras vid användandet av
{{cite web}}”. A Real-life 'I Am Legend?' Researcher Champions Development Of 'Reovirus' As Potential Treatment For Cancer. 9 May 2008.
