Myrsyra
| Myrsyra | ||||
 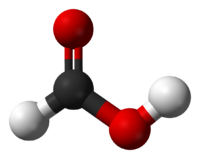 | ||||
| Systematiskt namn | Metansyra | |||
|---|---|---|---|---|
| Kemisk formel | CH2O2 eller HCOOH | |||
| Molmassa | 46,03 g/mol | |||
| Utseende | Färglös, vätska | |||
| CAS-nummer | 64-18-6 | |||
| SMILES | O=CO | |||
| Egenskaper | ||||
| Densitet | 1,2 g/cm³ | |||
| Löslighet (vatten) | Löslig | |||
| Smältpunkt | 8,4 °C | |||
| Kokpunkt | 100,8 °C | |||
| Faror | ||||
| Huvudfara |
| |||
| NFPA 704 | ||||
| SI-enheter & STP används om ej annat angivits | ||||

Myrsyra, även kallad metansyra, HCOOH, är den enklaste av karboxylsyrorna och därmed den enklaste organiska syran. Myrsyra utsöndras bland annat från giftkörtlar hos vissa arter av myror, därav namnet. Myrsyrans salter kallas formiater från syrans latinska namn acidum formicum, där formica betyder "myra". Härav kommer även orden formaldehyd och formalin.
Egenskaper[redigera | redigera wikitext]
Myrsyra är till skillnad från de flesta andra karboxylsyror en relativt stark syra varför man bör handskas med den med försiktighet. Myrsyra är precis som ättiksyra löslig i vatten och är även löslig i många andra organiska lösningsmedel. Till skillnad från många andra karboxylsyror såsom ättiksyra kan myrsyra under normala förhållanden inte bilda sin anhydrid, det vill säga formylformiat. Vill man bilda myrsyrans anhydrid kan man låta formylfluorid och natriumformiat reagera vid –78 °C. Med en alken kan myrsyra bilda estrar, formiatestrar.
Produktion[redigera | redigera wikitext]
När metanol och kolmonoxid kombineras med en stark bas som natriumhydroxid (NaOH) produceras estern metylformiat (CH3HCO2) som sedan medelst hydrolys kan sönderdelas till metanol och myrsyra.
Myrsyra bildas också när man destillerar en blandning av oxalsyra (C2O2[OH]2) och glycerol. I denna reaktion fungerar glycerol som en katalysator.
Myrsyra produceras ofta som biprodukt vid andra organiska reaktioner, men för att tillverka lika mycket syra som används behöver man producera mer än det man får som biprodukt.
Användning[redigera | redigera wikitext]
Myrsyra används i stor utsträckning i lantbruk i samband med ensilering av grönmassa vid vallskörden. Oftast används flytande ensileringsmedel bestående av myrsyra i kombination med andra syror eller konserveringsmedel. Myrsyra används även för bekämpning av varroakvalster i bisamhällen, då en 60 % lösning i vatten får avdunsta. Myrsyra förekommer i ett preparat för behandling av vårtor[1]. Myrsyra kan också användas i laboratorier för att framställa kolmonoxid.
Säkerhet, giftighet, hälsofaror[redigera | redigera wikitext]
Vid kontakt med koncentrerad myrsyra på kroppen (speciellt ögonen) kan frätsår skapas. Myrsyra utanpå kroppen är inte giftig, men om man dricker syran kan man få frätsår i strupen. Syran är lättflyktig och ångorna från koncentrerad syra irriterar ögonen och de övre luftvägarna.[2]
| Koncentration | Märksymbol |
|---|---|
| 2 %-10 % | Irriterande (Xi) |
| 10 %-90 % | Frätande (C) |
| >90 % | Frätande (C) |
En av de saker som orsakar metanolens (träspritens) giftighet är att levern bryter ner metanol till myrsyra vilket sänker blodets pH-värde. Detta tillstånd, acidos, kan i sig vara livshotande. Myrsyra och formaldehyd som bildas vid nedbrytning av metanol angriper synnerven och kan orsaka blindhet.
Förekomst i naturen[redigera | redigera wikitext]
Förutom hos myror finns även myrsyra i munkörtlarna hos vissa släkten gaddlösa bin (så kallade "eldbin", speciellt släktet Oxytrigona)[3], i brännhåren hos brännässla (Urtica dioica)[4][5], i svett och i urin.[6]
-
Brännässla (Urtica dioica)
-
Röd skogsmyra (Formica rufa)
-
Svett
Se även[redigera | redigera wikitext]
Källor[redigera | redigera wikitext]
- ^ ”VårtFri läkemedel”. http://www.vartfri.se/sv-se/vartbehandling/myrsyra/. Läst 27 augusti 2018.
- ^ Bo Birgersson, Olov Sterner, Erik Zimerson: Kemiska hälsorisker. Toxikologi i kemiskt perpektiv kap. "Karlboxylsyror". Liber Hermods, 1983.
- ^ David W. Roubik (2006). ”Stingless bee nesting biology” (på engelska) (PDF (967 kB)). Apidologie (37): sid. 6. doi:. http://hal.archives-ouvertes.fr/docs/00/89/22/07/PDF/hal-00892207.pdf. Läst 30 maj 2015.
- ^ Henriksson, Anders (2000). Naturkunskap B. Gleerups Utbildning AB. sid. 63. ISBN 91-40-63503-1
- ^ http://www.ne.se/brännässla - från Nationalencyklopedin på nätet - http://www.ne.se - läst datum: 18 mars 2014
- ^ http://www.alltomvetenskap.se/nyheter/hur-branns-nasslor - läst datum: 18 mars 2014 - från tidningen allt om vetenskap med startsidan: http://www.alltomvetenskap.se
Externa länkar[redigera | redigera wikitext]
 Wikimedia Commons har media som rör Myrsyra.
Wikimedia Commons har media som rör Myrsyra.











