Prolin
| Prolin | |
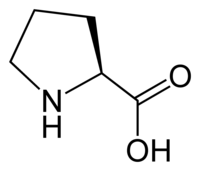  | |
| Systematiskt namn | Pyrrolidin-2-karboxylsyra |
|---|---|
| Kemisk formel | C5H9NO2 eller C4H8NCOOH |
| Molmassa | 115,1305 g/mol |
| Utseende | Färglösa kristaller |
| CAS-nummer | 609-36-9 |
| SMILES | C1CCNC1C(=O)O |
| Egenskaper | |
| Densitet | 1,36 g/cm³ |
| Löslighet (vatten) | 1500 g/l |
| Smältpunkt | 220 °C (sönderfaller) |
| SI-enheter & STP används om ej annat angivits | |
Prolin (förkortas Pro eller P) är kemisk förening[1] med summaformeln C5H9NO2. Ämnet är en av de 20 aminosyrorna som är byggstenar i proteiner. Ämnet tillhör gruppen neutrala, hydrofoba, opolära aminosyror.
Dess uppbyggnad skiljer sig något från de övriga genom att "R(e)-gruppen" även är bunden till amingruppen, detta bidrar till att ge en stabil struktur åt proteinet. Se artikeln för aminosyror.
I den genetiska koden kodas prolin av fyra kodon: CCU, CCC, CCA och CCG.
Till skillnad från de flesta andra aminosyror har prolin en cyklisk struktur där aminogruppen är bunden till sidokedjan istället för att vara separerad som en fristående grupp. Detta ger prolin en mer kompakt tredimensionell form. Den cykliska strukturen gör också prolins kväve oladdad, vilket skiljer sig från de flesta andra aminosyrorna. Dessa strukturella egenheter påverkar de proteiner som prolin ingår i och hur de veckar sig. Biosyntesen av prolin sker från aminosyran glutamat via flera steg där enzymer som pyrrolin-5-karboxylatsyntetas och prolinaminotransferas är inblandade. Vitaminet B6 fungerar som en kosymbions i denna process.
Prolin spelar en kritisk roll i strukturen av proteiner, särskilt i kollagen, där den bidrar till att bilda stabila trippelhelixar. Kollagen är ett huvudkomponent i bindväv och utgör en stor del av hud, ben, senor och ligament. På grund av dess ringstruktur introducerar prolin en "böj" eller "sväng" i polypeptidkedjor, vilket kan påverka proteiners sekundärstruktur, såsom alfa-helixar och beta-sheets.
I människokroppen
[redigera | redigera wikitext]Prolin har flera viktiga funktioner:
Ingår i proteinstrukturer och bidrar till veckning och stabilitet hos proteiner genom sin cykliska struktur. Antioxidanteffekter där prolins unika struktur kan skydda mot fria radikaler och oxidativ stress. Kollagenproduktion - prolin är ett nödvändigt byggämne för kollagenfibrerna som ger struktur åt hud, senor och brosk. Bidrar till produktionen av hyaluronsyra som håller samman kroppen vävnader och leder. Förbättrar sårläkning och benvävnadsreparation. Fungerar som osmoprotektant och skyddar celler från låga salthalter.
Prolin kan också omvandlas tillbaka till glutamat, vilket är viktigt för energiutvinning och metabolism under vissa specifika förhållanden.
Källor och brist
[redigera | redigera wikitext]Prolin finns naturligt i många animaliska och vegetabiliska livsmedel som kött, fisk, ägg, mejeriprodukter, nötter och baljväxter. Även om prolin är icke-essentiell kan ett för lågt intag bidra till hudproblem, sämre sårläkning och minskad bindvävselastisitet. Kraftig prolinbrist är dock ovanligt. De viktigaste funktionerna för prolin ligger i dess strukturella roller för proteiner och dess produktion av kollagen som ger kroppens vävnader stadga och elasticitet.
Användning
[redigera | redigera wikitext]Medicin: Prolin kan användas i vissa terapeutiska proteiner och peptider, där dess unika strukturella egenskaper kan förbättra stabiliteten och bioaktiviteten. Livsmedelsindustri: I livsmedelsindustrin kan prolin och kollagen användas som tillsatser för att förbättra textur och stabilitet i olika produkter. Prolin är alltså en mångsidig och viktig aminosyra med avgörande roller både i biologiska system och industriella tillämpningar
Referenser
[redigera | redigera wikitext]- ^ http://www.ne.se/lang/prolin & http://www.ne.se/enkel/aminosyror - från Nationalencyklopedin på nätet - http://www.ne.se - läst datum: 7 april 2014
| Den här artikeln behöver fler eller bättre källhänvisningar för att kunna verifieras. (2014-04) Åtgärda genom att lägga till pålitliga källor (gärna som fotnoter). Uppgifter utan källhänvisning kan ifrågasättas och tas bort utan att det behöver diskuteras på diskussionssidan. |
| |||||||||||||||||||
