Hemgrupp
- Se cellgrupp angående en mindre grupp inom kyrkor (ofta frikyrkor) som ibland kallas hemgrupp.
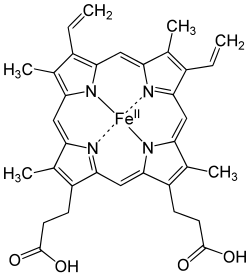
Hemgrupp, hem eller haem (uttalas med långt "e", he:m, från grekiska αἷμα, haima, "blod") eller med en äldre stavning hämgrupp, häm är en organisk heterocyklisk molekyl, som tjänar som kofaktor i ett flertal biokemiska processer. Hemgrupper består av ett skelett av kolväte, porfyrin, som binder metalljoner, ofta järn, i sitt centrum. Hemgruppen är en viktig kofaktor till de syrebindande proteinerna hemoglobin och myoglobin, men ingår även i ett flertal av kroppens enzymer däribland cytokrom c. De organ som främst ansvarar för syntesen av hem är levern och benmärgen.
En funktion hos hemgruppen är att binda syremolekyler, O2, och tillhanda dessa för enzymatiska reaktioner. Hem är inte bara en funktionell grupp i diverse redoxproteiner[1] utan är även en reglerande metabolit som har inflytande på uttrycket och aktiviteten hos många heminnehållande proteiner.[2] Eftersom cellens huvudsakliga centrum för oxidation är mitokondrien, innehåller denna många olika enzymer som innehåller hem. En liknande funktion för hemgruppen är i syretransportören hemoglobin, där hemet bär syre från lungorna till vävnaderna och där istället tar upp koldioxid. Dessutom kan hemgruppen fungera som elektrontransportör i till exempel cytokrom c, och som prostetisk grupp i enzym som peroxidaser. I båda dessa fall upptar och avger hemgruppen elektroner.
Ferrochelatase
[redigera | redigera wikitext]Den sista reaktionen när hem bildas är då Fe2+ sätts på plats i mitten av protoporfyrin.[3]
Enzymet som katalyserar denna reaktion kallas ferrochelatase. Mänskligt ferrochelatase är en homodimer.[3] Den membranfästa delen i mitokondriens inre reflekteras i proteinets hydrofoba slingor som bildar ingången till det aktiva sätet i varje monomer.[3] I homodimeren är monomererna besläktade genom en pseudo-dubbel symmetri med deras fickor på det aktiva stället vända mot samma hydrofoba yta.[3] Ferrochelatase hos människor har en C-terminal förlängning av cirka 40 aminosyror innehållande ett [2Fe-2S] kluster, en i varje monomer.[3] Klustret är placerat mellan monomererna.[3] Det ligeras av ett sällsynt cysteinmotiv där tre av cisteinerna som ligerar klustret är belägna i polypeptidens C-terminal och det fjärde cysteinet är beläget 200 aminosyror bakåt i sekvensen.[3] Inga ytterligare vätebindningar bidrar till ligeringen av klustret, till skillnad från många andra [2Fe-2S] klusterproteiner.[3] Dimerinteraktionerna stabiliseras av inter-subenhet vätebindningar och hydrofoba interaktioner mellan strukturer från C-terminalen.[3]
Den mänskliga genen för ferrochelatase finns vid kromosom 18q21.3 och består av 11 exoner.[3] En defekt i genen för ferrochelatase leder till en blodsjukdom som kallas EPP (Erytropoetisk protoporfyri).[3][4] Det är en ärftlig porfyri som resulterar i ackumulering av protoporfyriner i röda blodkroppar vilket orsakar ljuskänslighet och potentiell leversjukdom.[3][4] De mutationer som är ansvariga för att orsaka EPP är antingen punktmutationer eller exondeletioner.[3] Över 30 olika mutationer som orsakar EPP har beskrivits, varav alla utom två är belägna utanför enzymets aktiva säte.[3]
Med hjälp av strukturella studier[3] av enzymet tillsammans med och utan olika metall joner (koppar, kobolt, kadmium och zink) och protoporfyrin har det studerats hur och var de båda substraten binder in till enzymet.[3] Därmed har man kunnat skapa en hypotes för de olika stegen i reaktionsmekanismen.[3]
Syntes av hemgrupper
[redigera | redigera wikitext]I de flesta organismer (förutom växter och vissa bakterier) syntetiseras hem i åtta steg med hjälp av olika enzymer.[3] Hos djur och svampar sker de tre första och tre sista stegen av hemsyntes i mitokondrierna, medan de andra två sker i cytoplasman.[3] Det sista steget, där järnjonen sätts in i porfyrinringen, protoporfyrin IX (PPIX), katalyseras av ferrochelatase[3]. Under fysiologiska aeroba förhållanden finns järnjoner normalt som järn(III)joner i kroppen.[3] Med hjälp av enzymer kan järn(III)joner omvandlas till järn(II)joner i kontrollerade reaktioner i cellen.[3][5] Järn(II)jonen är den enda järnjonen som kan infogas i PPIX av ferrochelatase.[3] Fria järn(II)joner är dock farliga för celler då de enkelt aktiverar molekylärt syre vilket resulterar i bildning av radikaler och kraftfulla oxidationsmedel.[3] Detta förklarar varför koncentrationen av fria järn(II)joner i blodplasma är mindre än en femtomolär.[3] Många reaktioner som involverar järn(II)joner måste därför utföras i cellens organeller eller vesiklar där det är en kontrollerad miljö.[3]
I prokaryoter interagerar ferrochelatase direkt med ett järnreglerande protein, vilket länkar hemsyntesen med järnhomeostas på det sättet istället.[3] Hos djur och de flesta bakterier utgör ferrochelatase den fysiska länken mellan järnhomeostasen och hemproduktionen.[3] Således har ferrochelatase en nyckelposition i väsentliga processer för de flesta livsformer på jorden.[3]
Syntesen av tetrapyrrolen hem sker i levern och benmärgen, i båda fall sker syntesen enligt följande steg:
- Syntesen av hemgrupper börjar med glycin och succinyl-CoA, som via enzymet delta-aminolevulinatsyntas omvandlas till delta-aminolevulinsyra, ALA.
- ALA omvandlas till porfobilinogen, detta enzymatiska steg hämmas av bly och ackumuleringen av ALA är en av orsakerna bakom blyförgiftning.
- Porfobilinogenet omvandlas hydroxymetylbilan.
- Hydroxymetylbilanet omvandlas till uroporfyrinogen III.
- Uroporfyrinogen III omvandlas till coprouroporfyrinogen III
- Coprouroporfyrinogen III omvandlas till protoporfyrinogen IX.
- Protoporfyrinogen IX omvandlas till protoporfyrin IX.
- Protoporfyrin IX omvandlas till sist till hem. Detta steg hämmas också vid blyförgiftning.
Brist på något av enzymerna i denna syntesväg, eller förgiftning med ämnen som bly leder till ansamling av intermediärer, detta tillstånd kallas porfyri och ger olika symptom beroende på var i syntesen som processen avbryts.
Steg 8: Protoporfyrin IX omvandlas till hem
[redigera | redigera wikitext]Fe2+-jonen leds in till det aktiva sätet via elektromagnetiska krafter.[3] Till det aktiva sätet leds även protoporfyrin in, och strax innan metalljonen sätt på plats böjs en av ringarna i protoporfyrinet 36 grader.[3] Böjningen sker med hjälp av enzymets ringformade aminosyror i det aktiva sätet och förmodas underlätta för järnjonen att bindas till protoporfyrinet.[3] När järnjonen väl har satts på plats lossnar hemmolekylen från enzymet då den inte längre passar i enzymets bindningsficka och därmed kan en ny reaktionscykel börja.[3]
I sista steget av hemsyntesen sätter ferrochelatase järnatomen på plats i protoporfyrin IX som därmed bildar protohem (hem).[3] Två protoner avges under denna reaktion.[3][2]
Det första steget i den icke-enzymatiska porfyrinmetalleringen är deformation av porfyrinet.[3]
H2P↔H2P*
I den strukturella studien med den bundna isomeren av protoporfyrin i det aktiva sätet kan man se att pyrrolring A är metylerad samt lutad 36 grader från de övriga tre pyrrolringarna.[3][2] Detta indikerar att enzymet tiltar substratet porfyrin under reaktionen.[3] Således, genom att inducera denna distortion, accelererar chelataser detta nyckelsteg jämfört med den icke-enzymatiska profyrinmetalleringen avsevärt.[3]
Efter distortion är nästa steg i den icke-enzymatiska metalliseringsreaktionen en komplexbildning av substratmetallen och porfyrin.[3]
ML6+H2P* ↔ [ML6H2P*]2+
I enzymet är vägen till det aktiva sätet fyllt med sura aminosyror som regelbundet radat upp sig i en delvis π-helix för att leda metallen in i det aktiva sätet och därigenom påskynda komplexbildningen i den yttre sfären.[3] I det aktiva sätet visade sig även finnas en konserverad histidin.[3] Glutaminsyra visade sig också vara involverad i ligeringen av metallsubstratet, tillsammans med två ytterligare vattenmolekyler.[3]
I nästa steg antas enzymet påskynda ligand dissociation och första metall-kvävebindning genom metalligander som lätt kan dissocieras från metallen.[3]
[ML6H2P*]2+↔ [ML5-L-H2P]2+ ↔ ML5-H2P2+ + L
De här steget accelereras av tetrahedralkoordineringsgeometri som generellt sett är mer stabila och mer benägna att utbyta ligander snabbare än octahedralakomplex som ha samma typ av icke-chelaterade ligander.[3] Järnjonen kan forma tetrahedralkomplex, till skillnad från icke-substratmetaller.[3]
Bildandet av en andra metall-kvävebindningsmellanprodukt, det så kallade SAT-komplexet, (Sitting Atop Complex) är inte reversibelt, till skillnad från det komplexet med den första metall-kvävebindningsbildningen.[3]
ML5-H2P2+↔ MLn=H2P2+ + (5-n) L
I SAT-komplexet finns de två protonerna på pyrrolkvävet fortfarande kvar medan metallen bildar två metall-kvävebindningar.[3]
I strukturen med ferrochelatase och komplex med det metylerade porfyrinet visade sig att endast 1 av 8 isomerer i isomerblandningen hade bundit till det aktiva sätet.[3] Pyrrolring A kunde ses vara böjt mot en konserverad histidin aminosyra, samma aminosyra som hade påvisats vara involverad i metallbindning i andra strukturella mutationsstudier.[3]
För att ett SAT-komplex ska kunna bildas i ferrochelatase måste det konserverade histidinet vara involverat.[3] Således riktningen på den tiltade pyrrolringen som induceras av enzymet avgör på vilken sida av porfyrinet som SAT-komplexet bildas och var metallen introduceras in i ringen.[3]
I det sista steget sker deprotonering av SAT-komplexet och metalloporfyrinet bildas.[3]
MLn=H2P2+ ↔ MP + Ln+ 2H+
Den nuvarande datan visar på att detta steg inte är det som är begränsande.[3] Icke-enzymatiska experiment indikerar att det inte finns någon skillnad i hur snabbt protonerna avges från pyrrolringens kväveatomer jämfört med hur snabbt vätet avges.[3] Ferrochelatase är ett relativt långsamt enzym och kan endast omvandla de två substraten till en produkt på ungefär 18-29 minuter per enzym.[3] Protonöverföringar är därmed inte det som är begränsande i denna reaktion.[3] Med hjälp av kvantkemiska beräkningar kunde det visas att det kostade 25 kJ/mol i energi för att tilta en deprotonerad pyrrolring A 30 grader.[3][2] Dock kostade det mycket mer att tilta en protonerad (48 kJ/mol) eller en metallerad porfyrin (67 kJ/mol) på samma sätt.[3] Detta tyder på att protonöverlämning underlättar porfyrin deformation och att metalleringen av porpyrinet triggar lossningen av produkten.[3]
Nedbrytning av hemgrupper
[redigera | redigera wikitext]Nedbrytningen av hem bildar bland annat ämnena sterkobilin och urobilin, som ger avföringen och urinen dess färger. Nedbrytningen börjar då erytrocyter skadas eller bryts ner, vilket bland annat sker i mjälten. Detta frigör cellernas hemoglobin, som proteolyseras varpå fria aminosyror och hemgrupper bildas.
Hem bryts ned av hem-ogygnenas till biliverdin som sedan snabbt omvandlas av biliverdinreduktas till bilirubin. Bilirubin är känt för att ha antioxidativa och neuroprotektiva egenskaper.[3][6]
Hemgrupperna bryts sedan ner i följande steg:
- Hem bryts ner till koloxid, järnjoner och biliverdin, som är grönt till färgen.
- Biliverdinet bryts ner till bilirubin, som är rött.
- Bilirubinet binder till bärarproteinet albumin och transporteras med blodet till levern.
- I levern glukuronideras bilirubinet till bilirubinglukuronid, som är vattenlösligt och kan utsöndras till mag-tarmkanalen.
- I mag-tarmkanalen bryts bilirubinglukuroniden åter ner till bilirubin av bakterier i mag-tarmkanalen.
- Bilirubinet omvandlas till urobilinogen. En del av detta återabsorberas över tarmväggen till blodet och transporteras till njurarna.
- Urobilinogenet i tarmen omvandlas till sterkobilin, som är brunt till färgen och ger avföringen dess färg.
- Urobilinogenet i blodet transporteras till njurarna där det omvandlas till det gul-orangefärgade urobilin.
Källor
[redigera | redigera wikitext]- ^ Paoli, Massimo; Marles-Wright, Jon; Smith, Ann (2002-04-01). ”Structure–Function Relationships in Heme-Proteins”. DNA and Cell Biology 21 (4): sid. 271–280. doi:. ISSN 1044-5498. https://www.liebertpub.com/doi/10.1089/104454902753759690. Läst 11 maj 2022.
- ^ [a b c d] Lecerof, D.; Fodje, M.; Hansson, A.; Hansson, M.; Al-Karadaghi, S. (2000-03-17). ”Structural and mechanistic basis of porphyrin metallation by ferrochelatase11Edited by D. C. Rees” (på engelska). Journal of Molecular Biology 297 (1): sid. 221–232. doi:. ISSN 0022-2836. https://www.sciencedirect.com/science/article/pii/S0022283600935691. Läst 11 maj 2022.
- ^ [a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bc bd be bf bg bh bi] Lecerof, David (2002). Crystallographic studies on porphyrin metallation by ferrochelatase : when 2 become 1. ISBN 91-628-5268-X. OCLC 186005408. https://www.worldcat.org/oclc/186005408. Läst 11 maj 2022
- ^ [a b] ”Erytropoetisk protoporfyri”. Socialstyrelsen. https://www.socialstyrelsen.se/kunskapsstod-och-regler/omraden/sallsynta-halsotillstand/erytropoetisk-protoporfyri/. Läst 11 maj 2022.
- ^ Liu, Fengjuan; Jiang, Yao; Fan, Chuan; Zhang, Liyan; Hua, Yue; Zhang, Chunxian (2018-06-11). ”Fluorimetric and colorimetric analysis of total iron ions in blood or tap water using nitrogen-doped carbon dots with tunable fluorescence” (på engelska). New Journal of Chemistry 42 (12): sid. 9676–9683. doi:. ISSN 1369-9261. https://pubs.rsc.org/en/content/articlelanding/2018/nj/c8nj00711j. Läst 11 maj 2022.
- ^ Yoshida, Tadashi; Migita, Catharina Taiko (2000-11-01). ”Mechanism of heme degradation by heme oxygenase” (på engelska). Journal of Inorganic Biochemistry 82 (1): sid. 33–41. doi:. ISSN 0162-0134. https://www.sciencedirect.com/science/article/pii/S0162013400001562. Läst 11 maj 2022.
