Tryptofan
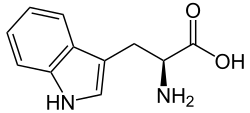

Tryptofan (förkortas Trp eller W) är inom biokemi en av de 20 aminosyror som är byggstenar i proteiner. Den tillhör gruppen opolära, hydrofoba aminosyror och är en av de essentiella aminosyrorna,[1] som kroppen inte själv kan tillverka, och som därför måste tillföras i födan. Bara L-stereoisomeren av tryptofan används som strukturellt enzymprotein; D-stereoisomeren är vanligast förekommande i naturligt producerade peptider. Det utmärkande strukturella kännetecknet för tryptofan är att den har en indol-grupp. Den är en av de två aminosyror som motsvaras av endast ett kodon (UGG) i den genetiska koden.
Tryptofan är också ett utgångsämne (substrat) vid kroppens tillverkning av serotonin[2] och melatonin som har betydelse för sömn, avslappning och stämningsläge och även blodkärlssammandragande. Tryptofan kan även användas för bildning av niacin.[3] I mat finns tryptofan i proteinrik föda, främst i kött och hårdost men även i mjölk och spannmål (se havregryn). Vissa nötter och frön har en hög halt av tryptofan; särskilt kan nämnas pumpafrökärnor och chiafrön. Kynurenin bildas i omsättningen av tryptofan.
Hos växter, svampar och bakterier är tryptofan substrat för biosyntesen av indolättiksyra.
Innehåll i olika livsmedel[redigera | redigera wikitext]
| Livsmedel | Protein [g/100 g livsmedel] |
Tryptofan [g/100 g livsmedel] |
Tryptofan/Protein [%] |
|---|---|---|---|
| kalkon |
|
|
|
| ost av cheddartyp |
|
|
|
| kyckling |
|
|
|
| nötkött |
|
|
|
| kotlett av lamm |
|
|
|
| kotlett av fläsk |
|
|
|
| lax |
|
|
|
| kolja |
|
|
|
| mjölk |
|
|
|
| sojabönor (råa) |
|
|
|
| ägg |
|
|
|
| vetemjöl |
|
|
|
| potatis |
|
|
|
| vitt ris |
|
|
|
Källa USA:s jordbruksdepartements livsmedelsdatabas
Fluorescensmätningar med hjälp av tryptofan[redigera | redigera wikitext]
Tryptofan är luminiscent och kan därför vara till hjälp vid koncentrationsbestämningar av proteinlösningar. De flesta fluorescensemissionerna av ett veckat protein sker på grund av excitationen av tryptofan. En del emissioner sker på grund av de aromatiska aminosyrorna tyrosin och fenylalanin. Man får dock se upp för disulfidbryggor (cystein kan bilda dessa) som också har ansenlig absorbans vid dessa våglängder. Tryptofan exciteras av fotoner med våglängderna 280–300 nm (nära UV) och erhåller en emissionstopp som är solvatokromatisk (möjligheten för en kemisk substans att ändra färg efter förändring i av lösningsmedlet, i detta fall polaritet hos lösningen) mellan 300 och 350 nm, beroende på lösningens polaritet. Ifall tryptofanerna är exponerade mot något polärt (till exempel ett lösningsmedel såsom vatten, etanol etcetera) kommer toppen på fluorescensen från tryptofan att närma sig våglängden 350 nm. Då tryptofan är i hydrofob (opolär) miljö (till exempel proteinets inre delar, ett denatureringsmedel etcetera) kommer toppen på fluorescensen att närma sig 300 nm (blåskift).
Det är därför man kan använda tryptofanfluorescens vid diagnos av konformationen (tertiärstruktur) hos ett protein. Problemet är att tryptofans fluorescens är starkt påverkad av närliggande protoniserade grupper, som till exempel asparagin och glycin, som kan orsaka utsläckning av tryptofans exciterade tillstånd. Även energiöverföring mellan tryptofan och andra fluorescerande aminosyror är möjlig, vilket påverkar analysen, särskilt när syra använts. Tryptofan är ganska ovanlig i proteiner; oftast innehåller ett protein en eller kanske några stycken tryptofaner. Därför kan tryptofanfluorescens vara en väldigt känslig mätmetod vid konformationsbestämning av individuella tryptofaner. Det som är positivt är att man inte behöver ändra proteinets veckning vid mätningarna; man påverkar inte proteinets egenskaper.
Referenser[redigera | redigera wikitext]
Noter[redigera | redigera wikitext]
- ^ ”Nationalencyklopedin, essentiella aminosyror”. Nationalencyklopedin. http://www.ne.se/uppslagsverk/encyklopedi/l%C3%A5ng/essentiella-aminosyror. Läst 21 juli 2017.
- ^ ”Kopplingen mellan autism, D-vitamin och serotonin”. www.nordicnutritioncouncil.com. Arkiverad från originalet den 8 september 2017. https://web.archive.org/web/20170908024028/http://www.nordicnutritioncouncil.com/kopplingen-mellan-autism-d-vitamin-och-serotonin/. Läst 21 juli 2017.
- ^ ”Niacin”. www.livsmedelsverket.se. https://www.livsmedelsverket.se/livsmedel-och-innehall/naringsamne/vitaminer-och-antioxidanter/niacin. Läst 21 juli 2017.
Externa länkar[redigera | redigera wikitext]
 Wikimedia Commons har media som rör Tryptofan.
Wikimedia Commons har media som rör Tryptofan.
| |||||||||||||||||||
|
