Kväve
| Kväve | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Flytande kväve  Urladdningsrör Emissionsspektrum | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generella egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relativ atommassa | 14,0067 (14,00643–14,00728)[1][2] u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Utseende | Färglös i gasform | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allotroper | Kvävgas (N2) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysikaliska egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitet vid 0 °C och 101,325 kPa | 1,251 g/L | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| – flytande, vid kokpunkten | 0,808 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregationstillstånd | Gas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smältpunkt | 63,15 K (−210 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kokpunkt | 77,355 K (−195,795 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trippelpunkt | 63,151 K (−209,999 °C) 12,52 kPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritisk punkt | 126,192 K (−146,958 °C) 3,3958 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molvolym | 13,54 × 10−6 m³/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smältvärme | 0,36 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ångbildningsvärme | 5,58[3] kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifik värmekapacitet | 1 040 J/(kg × K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molär värmekapacitet | 29,124 J/(mol × K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomära egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradie | 65 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent radie | 75 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| van der Waalsradie | 155 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronaffinitet | 7 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jonisationspotential | Första: 1 402,3 kJ/mol Andra: 2 856 kJ/mol Tredje: 4 578,1 kJ/mol Fjärde: 7 475 kJ/mol (Lista) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | [He] 2s2 2p3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
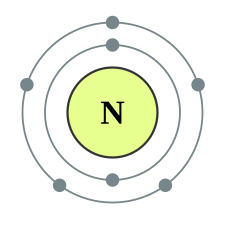
| e− per skal | 2, 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemiska egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationstillstånd | 5, 4, 3, 2, 1, −1, −2, −3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxider (basicitet) | N2O, NO, N2O3, NO2, N2O5 (starkt sur) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitet | 3,04 (Paulingskalan) 3,066 (Allenskalan) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diverse | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | Hexagonal  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ljudhastighet | 333,6 m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Värmeledningsförmåga | 0,02583 W/(m × K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetism | Diamagnetisk | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetisk susceptibilitet | −6,7 × 10−9[4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brytningsindex | 1,000298 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikation | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-nummer | 7727-37-9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-nummer | 231-783-9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pubchem | 947 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ATC-kod | V03AN04 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RTECS-nummer | QW9700000 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Namnursprung | Från grekiska nitron och -gen, vilket betyder ”niterbildande”.[5][6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Upptäckt | Daniel Rutherford (1772) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Namngivare | Jean-Antoine Chaptal (1790) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stabilaste isotoper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Säkerhetsinformation | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Säkerhetsdatablad: Sigma-Aldrich | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| H-fraser | H280 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| P-fraser | P403 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SI-enheter och STP används om inget annat anges. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Kväve eller nitrogen (latin: Nitrogenium) är grundämnet med tecknet N och atomnummer 7. Kväve förekommer rikligt i atmosfären som allotropen kvävgas (N2) där den står för cirka 78 % av volymen.
Egenskaper
[redigera | redigera wikitext]Kvävgas är färglös och kemiskt trögreaktivt beroende på att dess två atomer i molekylen (N2) binds med en trippelbindning som är svår att lösa upp. Vid hög energitillförsel, till exempel elektriska urladdningar, sönderdelas kvävgasmolekylen dock till enskilda atomer som lätt reagerar – vid elektrisk urladdning i luft (kväve, syre och spår av andra gaser) bildas flera kväveoxider, bland annat kväve(mon)oxid NO och kvävedioxid NO2. Dessa bildas också vid flera typer av förbränning och kemiska industriella processer och kallas då ofta ”NOx”. Vid reaktion med vatten bildar dessa gaser salpetersyrlighet HNO2 och salpetersyra HNO3, vilka kan ge ett stort bidrag till försurning av miljön vid nederbörd. Dikväveoxid N2O (Lustgas, äldre benämning kväveoxidul) används som bedövningsmedel vid t.ex. förlossningar.
Föreningar
[redigera | redigera wikitext]Kväve har fem elektroner i sitt yttersta elektronskal. Därmed kan det i sitt grundtillstånd bilda tre kovalenta bindningar. Förlorar den en elektron kan den bilda fyra, som i ammoniumjonen. Kväve bildar inte anjoner direkt. Kvävets viktigaste föreningar är:
- Ammoniak (NH3) – en färglös, giftig och illaluktande gas med kokpunkt −33 °C, som används i kemiindustrin för bland annat framställning av gödselmedel och sprängämnen. Vidare används ammoniak som kylmedium i större kylanläggningar. I vattenlösning är den en svag bas.
- Ammoniumsalter – ammoniak bildar tillsammans med syror ammoniumsalter, vilka då innehåller den positiva jonen NH4+, vilken kemiskt påminner om en alkalimetalljon. Ett exempel är ammoniumnitraten NH4NO3, vilket används som gödselmedel.
- Salpetersyra (HNO3) – en färglös vätska som stelnar vid −42 °C och kokar vid 84 °C. Det är en stark syra som vid reaktion med metaller bildar nitrater innehållande den negativa jonen NO3−. Salpetersyra används som råvara för tillverkning av gödsel och sprängämnen.
- Aminosyrorna – utgör de viktigaste byggstenarna för livet. De har aminogrupp NH2 kopplad till kolvätekedjor. Kväve är således av yttersta vikt för den organiska kemin.
- Vätecyanid (HCN) – en mycket giftig gas eller vätska. Den används som råvara för tillverkning av plaster och pigment.
Användning
[redigera | redigera wikitext]Kväve används på grund av sin reaktionströghet som skyddsgas vid metallurgiska processer, och i vissa glödlampor, ofta blandat med argon.
Kväve används som förpackningsgas i livsmedel för att bevara varan man förpackar och har E-nummer E941. Även en blandning av kväve och koldioxid är vanlig för detta ändamål, och användningsområdet inkluderar exempelvis kött, charkprodukter och öl.[8]
Ett av de största användningsområdena för kväve är tillverkning av ammoniak. Ammoniaken produceras genom sammanslagning av kväve och väte i en process som kallas Haber-Boschprocessen. I Haber-Boschprocessen blandas kväve och väte i proportionerna 1:3 och utsätts för 200 atmosfärer tryck och leds vid 400 °C förbi en katalysator av järnoxid varvid ammoniak bildas.
- N2 + 3H2 → 2NH3
Ammoniaken kan sedan användas för att bilda salpetersyra genom att ledas över en koppar- eller platinakatalysator tillsammans med syrgas. Ammoniak används även för framställning av bland annat konstgödsel (ammonium- och nitratsalter) samt sprängämnen (ammoniumnitrat) samt som kylmedel.
Jordbruk
[redigera | redigera wikitext]Kväve är ett nödvändigt grundämne i allt liv, bland annat som en beståndsdel i aminosyrorna – proteinernas byggstenar. Detta är viktigt när vi ser på jordbrukets förändring. Innan 1920-talet fanns enbart kväve i form av gödsel från djur. Tillgång på kväve var en begränsande faktor för jordbruket. Mer kväve får grödorna att växa sig större men kvävefixering i naturen tar lång tid och gödsel från djur innehöll en mindre del kväve. Den större delen av kvävet försvann med djuret som mjölk och kött. Med Haber-Boschprocessen upptäckte man konstgödsel. Detta blev det nya sättet för jordbruket att få grödorna att växa sig stora. Detta fick produktionen av vår mat att öka trefaldigt. Hälften av allt kväve som finns i människokroppen kommer från syntetiskt kväve.
Kvävgas i däck
[redigera | redigera wikitext]Kvävgas används till att fylla däcken på racerbilar, flygplan, tunga transportfordon och även till vanliga passagerarbilar.[9]
Flytande kväve
[redigera | redigera wikitext]
Flytande kväve är kväve i flytande form. Den kan betecknas LN2. Flytande kväve kokar vid 77 K eller −196 grader Celsius.
Flytande kväve används till att kyla snabbt och hålla kallt, bland annat:
- Snabb kylning av mat, så att inte iskristaller bildas som kan förstöra matens celler.
- Kryo-kylning av levande organismer eller av oönskad vävnad inom kryoteknik.
- Kylmedel – exempelvis för att kyla anordningar som i sin tur kyls med flytande helium för att kyla supraledande magneter till nmr-spektroskopi och MRI.
- Kapning av metaller – om metallen kyls med flytande kväve kan det räcka med en liten stöt för att metallen ska knäckas.
Förekomst och framställning
[redigera | redigera wikitext]Kväve är den vanligaste gasen i jordens atmosfär följd av syre, men i jordskorpan är kväve mindre vanligt med en halt av i medeltal 25 gram/ton.
| Gas | Kokpunkt | Volymprocent i luft vid havsnivå [10] |
|---|---|---|
| Kväve | −196 °C | 78,073 % |
| Syre | −183 °C | 20,947 % |
| Koldioxid | −78 °C | 0,04 % |
| Ädelgaser | Varierande | 0,94 % |
Kväve framställs genom fraktionerad destillation av flytande luft. Den erhålls som en biprodukt vid framställning av den tekniskt viktiga syrgasen (oxygen). Ren kvävgas är därför förhållandevis billig.
Säkerhet
[redigera | redigera wikitext]Kontakt med flytande kväve, kylsprejer eller föremål som kyls med flytande kväve kan orsaka köldskador. Hantering av flytande kväve bör ske i öppna ytor eller väl ventilerade rum, då kväve stöter bort syre och orsakar kvävning.
Historia
[redigera | redigera wikitext]Kvävet upptäcktes av botanikprofessorn Daniel Rutherford (1772) i Edinburgh, som stängde in möss i en sluten behållare och avlägsnade koldioxiden från den kvarvarande gasen efter djurens död. Han fann att den återstående gasen kvävde eld och dödade djur. [11]
Svensken Carl Wilhelm Scheele visade samma år att luft består av två komponenter kallade eldsluft (syre) och skämd luft (resten, det vill säga mest kväve) – fransmannen Antoine Laurent de Lavoisier döpte om den skämda luften till azote och var också den som insåg att kväve var ett grundämne i modern bemärkelse.[11] Engelsmannen John Dalton presenterade azote som ett grundämne i sin publicerade atomteori (1807). Det internationella namnet nitrogene/nitrogenium tillkom 1790 på grund av upptäckta samband mellan kväve och salpetersyra (νίτρον; grekiska för ”salpeter”). Det svenska namnet kväve föreslogs av Pehr von Afzelius och Anders Gustaf Ekeberg (1795) för dess eldkvävande egenskaper.
Isotoper
[redigera | redigera wikitext]Naturligt förekommande kväve består av två stabila isotoper: 14N (99,64 %) och 15N (0,36 %). Dessutom är 14 kända isotoper instabila (och därmed radioaktiva). De mest stabila av dessa är 13N med halveringstid 9,965 minuter, 16N med halveringstid 7,13 sekunder och 17N med halveringstid 4,173 sekunder. Alla de resterande isotoperna har halveringstider kortare än en 1 sekund, och de flesta kortare än 110 millisekunder.[12]
Galleri
[redigera | redigera wikitext]-
Glödande ultrarent kväve.
-
En behållare för flytande kväve.
-
Metallkopp med flytande kväve.
Källor
[redigera | redigera wikitext]- ^ Här anges det av IUPAC rekommenderade standardvärdet. Se: Michael E. Wieser, Tyler B. Coplen: Atomic weights of the elements 2009 (IUPAC Technical Report). In: Pure and Applied Chemistry. 2010, S. 1, doi:10.1351/PAC-REP-10-09-14.
- ^ IUPAC, Standard Atomic Weights Revised 2013.
- ^ Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- ^ Weast, Robert C. (ed. in chief): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990. Seiten E-129 bis E-145. ISBN 0-8493-0470-9. De angivna värdena har här räknats om enligt SI.
- ^ Royal Society of Chemistry – Visual Element Periodic Table
- ^ – Online Etymological Dictionary
- ^ Kväve i substansdatabasen GESTIS-Stoffdatenbank hos IFA (Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung). Läst 11 mars 2011. (JavaScript krävs)
- ^ Air Liquide: Förpackning Arkiverad 27 januari 2013 hämtat från the Wayback Machine., läst 2012-12-26
- ^ ”AGA”. Arkiverad från originalet den 8 mars 2016. https://web.archive.org/web/20160308014605/http://www.aga.se/sv/products_ren/nitrogen_tyres/index.html. Läst 28 februari 2016.
- ^ På hög höjd är sammansättningen annorlunda
- ^ [a b] Anders Lennartsson, Periodiska systemet, Studentlitteratur, 2011
- ^ Lawrence Berkeley National Laboratory - Isotoptabell för kväve Arkiverad 12 augusti 2009 hämtat från the Wayback Machine.
Externa länkar
[redigera | redigera wikitext] Wikimedia Commons har media som rör Kväve.
Wikimedia Commons har media som rör Kväve.
|





