Fosfor
| Fosfor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Vaxvit, röd och violett fosfor.  Emissionsspektrum | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generella egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relativ atommassa | 30,973761998(5)[1] u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Utseende | Färglös, vaxvit, gul, scharlakansröd, röd, violett, svart. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allotroper | Vit fosfor (V) Röd fosfor (R) Svart fosfor (S) Violett fosfor (Vi) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysikaliska egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitet vid r.t. | V: 1,823 g/cm3 R: ≈ 2,2–2,34 g/cm3 S: 2,69 g/cm3 Vi: 2,36 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregationstillstånd | Fast | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smältpunkt | 317,3 K (44,15 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kokpunkt | 553,2 K (276,85 °C)[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molvolym | 17,02 × 10−6 m³/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smältvärme | V: 0,66 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ångbildningsvärme | V: 51,9[2] kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifik värmekapacitet | R: 685,6[3] J/(kg × K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molär värmekapacitet | V: 23,824 J/(mol × K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomära egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradie | 100 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent radie | 106 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| van der Waalsradie | 180 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronaffinitet | 72 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jonisationspotential | Första: 1 011,8 kJ/mol Andra: 1 907 kJ/mol Tredje: 2 914,1 kJ/mol Fjärde: 4 963,6 kJ/mol (Lista) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | [Ne] 3s2 3p3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
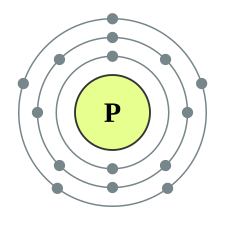
| e− per skal | 2, 8, 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemiska egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationstillstånd | 5, 4, 3, 2,[4] 1,[5] −1, −2, −3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxider (basicitet) | P2O5 (svagt sur) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitet | 2,19 (Paulingskalan) 2,253 (Allenskalan) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diverse | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | Kubisk rymdcentrerad  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Värmeledningsförmåga | V: 0,236 W/(m × K) S: 12,1 W/(m × K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrisk konduktivitet | 10−9 A/(V × m) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrisk resistivitet | 102 nΩ × m (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetism | Diamagnetisk[6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetisk susceptibilitet | R: −1,9 × 10−5[7] S: −2,9 × 10−5[7] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brytningsindex | 1,001212 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kompressionsmodul | V: 5 GPa R: 11 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikation | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RTECS-nummer | TH3495000, TH3500000 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Namnursprung | Från grekiska phosphoros, ”ljusbärare”[8][9] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Upptäckt | Henning Brand (1669) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fastställt som ett grundämne av | Antoine Lavoisier (1777)[10] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stabilaste isotoper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Säkerhetsinformation | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Säkerhetsdatablad: Sigma-Aldrich | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| H-fraser | Röd: H228, H412 Vit: H250, H300, H314, H330, H400 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| P-fraser | Röd: P210, P275[11] Vit: P? | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SI-enheter och STP används om inget annat anges. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Fosfor (från det grekiska ordet φωσφόρος, phoosforos, "ljusbärare") (latinskt namn: Phosphorus) (P) är ett icke-metalliskt grundämne tillhörande kvävegruppen. Fosfor ingår i kemiskt bunden form i RNA och DNA, och är nödvändig för alla levande celler. Fosfor kan inte hittas i fri form i naturen, på grund av hög kemisk reaktionsförmåga.
Fri fosfor används i formen vit fosfor i lysgranater och i brandbomber. "Fosfor" finns också i formen röd fosfor i plånet på tändsticksaskar.
Fosforföreningar ingår i NPK (konstgödsel), vilket är det viktigaste kommersiella användningsområdet. Fosforföreningar förekommer även i nervgaser, bekämpningsmedel, tandkräm och tvättmedel. Fosfor upptäcktes av tysken Henning Brand på 1600-talet.
I människokroppen har fosfor till funktion att bidra till fosforylering.[13] Detta inträffar i viktiga processer som proteinkinasen och cellens energihantering (se exempelvis adenosintrifosfat och oxidativ fosforylering).
Fri fosfor[redigera | redigera wikitext]
Fosfor förekommer i ren form i flera allotroper.
Vit fosfor (även kallad gul fosfor), som var den första formen av fri fosfor att upptäckas (år 1669), sänder ut ett blekt ljus vid kontakt med luft (eftersom luft innehåller syre) och har på grund av detta fått sitt namn från Φωσφόρος som är grekiska och betyder ljusbäraren (latin: Lucifer), vilket syftar på "Morgonstjärnan", alltså planeten Venus.
Vit fosfor består av P4-molekyler där atomerna ligger i hörnen av en tetrader och varje atom binder till övriga tre fosforatomer. Vit fosfor finns i två former, alfa och beta, som skiljer sig åt beträffande hur P4-molekylerna är packade i förhållande till varandra.
Vit fosfor används bland annat i brand- och rökgranater. Det självantänder snart om det förvaras i luft och är mjukt som ost. För att kunna skäras utan att antändas måste vit fosfor skäras under vatten. Vit fosfor är mycket giftigt. Tillsammans med syre brinner fosfor till en vit rök av fosforpentoxid, som kraftigt drar till sig vatten varvid det under värmeutveckling bildas fosforsyra.
Röd fosfor, som är en annan (omvandlings-)form av fri fosfor, reagerar svagare men ändå explosionsartat vid mekanisk påverkan i kombination med oxidationsmedel och är den aktiva beståndsdelen i plånet på tändsticksaskar. Röd fosfor har inte alls samma toxiska egenskaper som vit fosfor. Röd fosfor är en polymer där många fosforatomer binder till varandra. Den är amorf och kan betraktas som en övergångsform till violett fosfor.
Violett fosfor är en kristallin form som kan framställas genom kristallisation ur en blysmälta ("Hittorfs fosfor"). Den är mindre reaktiv än den röda fosforn.
Svart fosfor, som kan framställas vid högt tryck och temperatur, är grafitliknande.
Föreningar[redigera | redigera wikitext]
Fosfor bildar många både oorganiska och organiska föreningar, av vilka flera har stor biologisk betydelse.
Biologisk betydelse[redigera | redigera wikitext]
Den största delen av all fosfor, cirka 86 %, som finns upplagrad i kroppen finns i benvävnad och tänder i form av svårlösliga kalcium-fosforföreningar. 8 till 9 % finns i musklerna och resten i organen och blodet.
Fosfor reagerar med bisköldkörtelhormon, och ingår i många av de enzymer som styr näringsomsättningen och har därmed en viss betydelse för omsättningen av fett och kolhydrater. Det är dessutom en beståndsdel av den viktiga ATP-molekylen, som är kroppens viktigaste energireserv. Fosfor medverkar även vid bildandet av nukleinsyra, som bär på arvsanlagen, och ingår i fosfolipiderna som reglerar fettomsättningen och blodets fettbalans. Det har betydelse för utnyttjandet av hormonerna, genom att fosforhaltiga föreningar transporterar hormonerna från cellmembranens yttersidor in i cellerna.
Brist på fosfor i kroppen (hypofosfatemi) kan leda till besvär med bukspottkörteln, mjuk benvävnad, tandbesvär, hämmad tillväxt, viktförlust, försämring av hjärnans och nervernas kapacitet och allmän svaghet (fatigue).
Om man däremot ständigt har ett för högt intag (hyperfosfatemi), förskjuts blodets syrabasbalans i sur riktning (mot acidos), vilket i sin tur resulterar i att stora mängder kalcium mobiliseras från benvävnaden och i en förening med fosforöverskottet förs ut med urinen. Till följd av fosforöverskottet uppstår en kalciumbrist och dessutom en kraftig ökning av blodets fetthalt och därmed möjliga cirkulationsbesvär. En kosthållning som innebär stora mängder kött eller fisk leder till att man får i sig 3 till 4 gånger mer fosfor än nödvändigt, vilket kan ge hälsomässiga följder.
Fosfor finns mest i kött, fisk, fågel, ägg, korn, ris, mejeriprodukter, öljäst, lecitin, ärtväxter och torkad frukt.
Rekommenderat dagligt intag: Barn 280–540 mg, vuxna 600–700 mg (ammande kvinnor 900 mg). Se vidare RDI-tabell.
Enligt Livsmedelsverkets rikstäckande undersökning av kostvanor i den svenska befolkningen, Riksmaten - 2010-11, var intaget av fosfor i genomsnitt 1 374 mg per dag, varav 1 242 mg för kvinnor och 1 541 mg för män.[14]
Organismen GFAJ-1 kan ha ersatt fosfor i föreningar med arsenik, men detta är omdiskuterat.[15]
Historik[redigera | redigera wikitext]
Fosfor upptäcktes 1669 av den tyske alkemisten Henning Brand, när han försökte skapa guld av mänsklig urin. Efter att ha hemlighållit framställningsmetoden en tid sålde han den till Johan Daniel Krafft. Denne visade det bl. a. för den engelske kemisten och fysikern Robert Boyle, som lyckades komma på metoden och publicerade den 1680. År 1769 fann svensken Carl Wilhelm Scheele ett enklare och billigare sätt för framställning från ben. [16]
Förr användes vit fosfor i tändstickstillverkning till tändstickornas tändsatser, vilket var farligt på grund av ämnets giftighet. Mord, självmord och oavsiktliga förgiftningar förekom. Tändsticksarbetare som utsattes för fosforångor drabbades av nekros i käkbenen, så kallad fosforkäke. När en säker metod för framställning av röd fosfor upptäcktes, så stiftades lagar som krävde en övergång till röd fosfor i tändstickstillverkningen. Det var svensken Carl Wilhelm Scheele som kom på hur man skulle kunna tillverka fosfor industriellt. Den kunskapen ledde senare till tändstickan.
Fosfor och internationell rätt[redigera | redigera wikitext]
Det finns i internationell rätt inte konventioner som begränsar användandet av just "vit fosfor", utan konventionerna gäller användandet av brandbomber som ofta innehåller vit fosfor. Konventionerna är tydliga med att lysgranater eller rökgranater, inte är att betrakta som brandbomber. Det finns därför inga begränsningar för användandet av vit fosfor i lysgranater eller rökgranater.
Referenser[redigera | redigera wikitext]
Noter[redigera | redigera wikitext]
- ^ Commission on Isotopic Abundances and Atomic Weights (2021). ”Standard atomic weights”. IUPAC. https://www.ciaaw.org/atomic-weights.htm. Läst 28 juli 2022.
- ^ [a b] Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- ^ Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag 1999, ISBN 3-7776-0736-3.
- ^ webelements
- ^ Ellis, Bobby D.; MacDonald, Charles L. B. (2006). ”Phosphorus(I) Iodide: A Versatile Metathesis Reagent for the Synthesis of Low Oxidation State Phosphorus Compounds”. Inorganic Chemistry 45 (17): sid. 6864–74. doi:. PMID 16903744.
- ^ Magnetic susceptibility of the elements and inorganic compounds Arkiverad 12 januari 2012 hämtat från the Wayback Machine., in Lide, David R., red (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5
- ^ [a b] David R. Lide (red.): Properties of the Elements and Inorganic Compounds, sid. 4:142–4:147, i: CRC Handbook of Chemistry and Physics, uppl. 90 (internetversion: 2010), CRC Press / Taylor and Francis. De angivna värdena har här räknats om enligt SI.
- ^ ”Phosphorus – Element information, properties and uses”. www.rsc.org. Royal Society of Chemistry. https://www.rsc.org/periodic-table/element/15/phosphorus. Läst 28 juli 2022.
- ^ ”Phosphorus”. www.etymonline.com. Online Etymological Dictionary. https://www.etymonline.com/search?q=Phosphorus. Läst 28 juli 2022.
- ^ cf. "Memoir on Combustion in General" Mémoires de l'Académie Royale des Sciences 1777, 592–600. from Henry Marshall Leicester and Herbert S. Klickstein, A Source Book in Chemistry 1400–1900 (New York: McGraw Hill, 1952)
- ^ Röd fosfor i substansdatabasen GESTIS-Stoffdatenbank hos IFA (Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung). Läst 25 januari 2010. (JavaScript krävs)
- ^ Ur CLP-förordningen gällande CAS-Nr. 7723-14-0 i substansdatabasen GESTIS-Stoffdatenbank hos IFA (Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung) (Kräver JavaScript) (ty, en).
- ^ https://runeberg.org/medterm/0176.html
- ^ Amcoff, Elisabet m.fl. (2012). Riksmaten - vuxna 2010-11 : Livsmedels- och näringsintag bland vuxna i Sverige. Uppsala: Livsmedelsverket. sid. 102. ISBN 978 91 7714 216 4. http://www.livsmedelsverket.se/globalassets/publikationsdatabas/rapporter/2011/riksmaten_2010_20111.pdf. Läst 4 augusti 2019
- ^ ”Arsenic-based life debate continues”. Arkiverad från originalet den 29 december 2011. https://web.archive.org/web/20111229160622/http://the-scientist.com/2011/06/02/arsenic-based-life-debate-continues/. Läst 21 december 2011.
- ^ Anders Lennartsson, Periodiska systemet, Studentlitteratur, 2011
Källor[redigera | redigera wikitext]
- Nationalencyklopedin 6. Bra Böcker. 1989. sid. 542. ISBN 91-7024-621-1
- Sherwood, Martin (1990). Kemin, Grundämnen & föreningar. Bonniers. sid. 48. ISBN 91-34-50893-7
Externa länkar[redigera | redigera wikitext]
 Wikimedia Commons har media som rör Fosfor.
Wikimedia Commons har media som rör Fosfor.
|




